-
过氧化钙品体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌消毒。以贝壳为原料制备CaO2的流程如下:
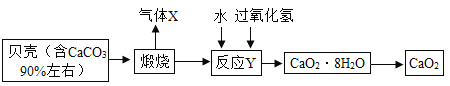
(1)过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,厂泛应用于环境杀菌、消毒。这句话中描叙了过氧化钙的哪些物理性质____(任意答两点),CaO2中O元素的化合价为___价。
(2)气体X的化学式是____;将过氧化钙晶体与溶液分离的方法是____。
(3)贝壳煅烧的产物之一是生石灰(CaO),反应Y发生的是化合反应,反应产物是CaO2·8H2O,请写出该反应的化学方程式____。
-
过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
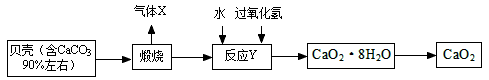
(1)气体X是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中,反应产物是CaO2·8H2O,,请写出化学方程式 该反应的基本反应类型是 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
-
过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
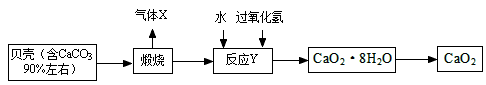
(1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O 2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
-
过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:

(1)气体X是__________;将过氧化钙晶体与溶液分离的方法是_________。
(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中,反应产物是CaO2·8H2O,请写出化学方程式_______________________,该反应的基本反应类型是_________。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是______________________。
-
过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
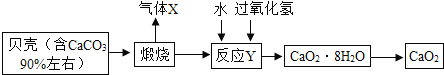
(1)气体X是________;将过氧化钙晶体与溶液分离的方法是_________。
(2)反应Y(反应物为氧化钙、水、过氧化氢)需控制温度在0-5℃,可将反应容器放在冰水混合物中,反应产物是CaO2·8H2O.请写出化学方程_______。反应的基本反应类型是_______。
(3)获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是_______。
-
工业产品过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛用于环境杀菌、消毒。以贝壳(主要成分是 CaCO3,杂质不参加反应也不溶于水)为原料制备 CaO2的流程如下:
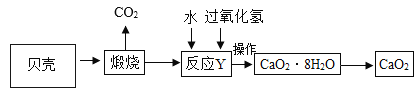
(1)CaO2中氧元素的化合价为___________;
(2)上述流程中将过氧化钙晶体从溶液中分离的步骤是过滤,该操作中用到的玻璃仪器有玻璃棒、 烧杯和_______________,其中玻璃棒的作用是_______________;
(3)反应 Y 需要在低温条件下进行,其原因是_________________;
(4)获取的 CaO2 中常含有 Ca(OH)2 杂质,原因是_______________(用化学方程式表示)。
-
过氧化钙晶体较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒.以贝壳为原料制备过氧化钙晶体流程如下:

(1)反应Y需控制温度在0~5℃,可将反应容器浸放在 中;反应Y的化学方程式为 ,该反应的类型为 反应(填“化合”或“分解”);将过氧化钙晶体与溶液分离的方法是 .
(2)获得的过氧化钙晶体中常含有Ca(OH)2杂质,可能的原因是 (之一即可),过氧化钙晶体(CaO2•8H2O)中H、O元素的质量比为 .
-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如图1:
已知:CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl。
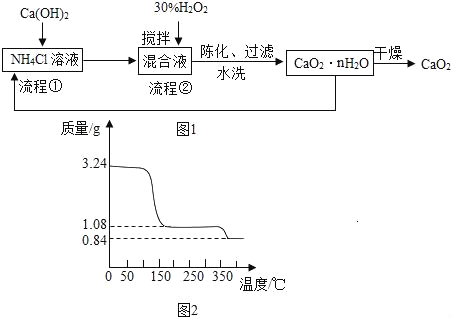
(1)搅拌的目的是_____。
(2)流程②中没有采用加热措施的可能原因是_____。
(3)整个流程中,除水外还可以循环使用的物质是_____。
(4)过滤操作中需要的玻璃仪器有漏斗、烧杯和_____,该仪器的作用是_____,检验CaO2•nH2O是否洗涤干净的方法是_____。
(5)取上述制得的CaO2•nH2O晶体进行热重分析,其热分解时晶体的质量分数随温度变化的曲线如图2,通过计算可得出n=_____。
-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如图1:
已知:CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl。
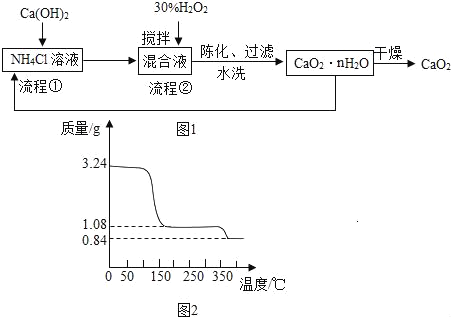
(1)搅拌的目的是_____。
(2)流程②中没有采用加热措施的可能原因是_____。
(3)整个流程中,除水外还可以循环使用的物质是_____。
(4)过滤操作中需要的玻璃仪器有漏斗、烧杯和_____,该仪器的作用是_____,检验CaO2•nH2O是否洗涤干净的方法是_____。
(5)取上述制得的CaO2•nH2O晶体进行热重分析,其热分解时晶体的质量分数随温度变化的曲线如图2,通过计算可得出n=_____。
-
过氧化钙(CaO2)具有较强的漂白、杀菌消毒作用,对环境无危害,是一种很有应用价值和发展前途的化工产品.工业上利用双氧水和氢氧化钙制备CaO2,已知:双氧水高温下不稳定、会分解.如图是简化后的工艺流程,请回答下列问题.

(1)生石灰中加水发生的化学反应方程式是______,该反应是______反应(填“放热”或“吸热”).在加入双氧水前,氢氧化钙浆料需经过______处理(填“保温”、“升温”、“降温”)处理.
(2)氢氧化钙浆料中加入双氧水的反应属于化合反应,则反应方程式为______,获得的产品CaO2•8H2O的相对分子质量为______,其中Ca、O、H的元素质量比为______.
(3)CaO2常用于鱼虾运输过程中的供氧剂,其反应原理是:2CaO2+2______=2Ca(OH)2+O2↑,若需要提供12.8g氧气,则需要CaO2______g.Na2O2也能与水反应原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析其原因______.

2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。








