-
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K)
938
1100
K
0.68
0.40
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________(填“增大”“减小”或“不变”,下同);充入氦气,混合气体的密度 ________。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
①上述盐溶液中的阴离子,结合质子能力最强的是_________________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:____________________________________________________________。
④含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:

若处理后的废水中残留的c(Fe3+)=4.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____ mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
高二化学综合题困难题查看答案及解析
-
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K)
938
1 100
K
0.68
0.40
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
高二化学填空题中等难度题查看答案及解析
-
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
T/K
938
1100
K
0.68
0.40
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________;充入氮气,混合气体的密度__________________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
①上述盐溶液中的阴离子,水解能力最弱的是__________________。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______(填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______(填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于_______mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
高二化学综合题中等难度题查看答案及解析
-
化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
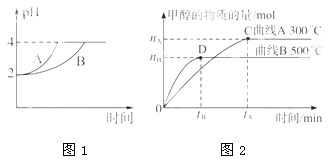
(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:

常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
高二化学综合题困难题查看答案及解析
-
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
①上述盐溶液中的阴离子,结合质子能力最强的是______________
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________
A HCN B HClO C C6H5OH D CH3COOH E H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。
高二化学填空题困难题查看答案及解析
-
(20分)选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是________;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是________。
A. 增加C的物质的量 B. 加压
C. 升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是________ ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则
m1________ m2 ( 选填“<”、“=”、“>”)
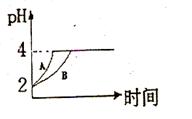
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K= ________,升高温度,K值________(填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s)
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于________; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于________。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈________性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论)________。
高二化学填空题极难题查看答案及解析
-
本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
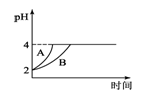
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
高二化学填空题困难题查看答案及解析
-
本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
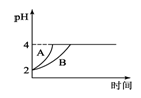
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
高二化学填空题困难题查看答案及解析
-
(12分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)
H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是________
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3) 在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,溶液中
c(Ag+)________(选填“变大”、“变小”、“不变”)
高二化学填空题简单题查看答案及解析
-
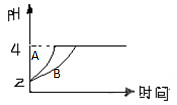
(8分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)
4C(g)
H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
①增加C的物质的量 ②加 压 ③升 温 ④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化 如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1________m 2(选填“<”、“=”、“>”)
高二化学填空题简单题查看答案及解析