-
铁及其化合物在生产生活中应用广泛。
(一)铁的性质和应用
(1)某麦片中含微量铁粉,食用后铁粉与胃酸(含HCl)反应转化为人体可吸收的铁元素,反应的化学方程式为_____________________;
(2)人体缺Fe2+影响健康(已知: Fe2+在空气中 易被氧化成Fe3+)。
①琥珀酸亚铁(化学式: FeC4H4O4)是常用补铁剂,其相对分子质量为_____________________;
②硫酸亚铁糖衣片亦能补铁,糖衣除包装药物外,另一作用是_____________________;高铁酸钾是高效杀菌净水剂,反应原理为:  。 x的化学式为_____________________;
。 x的化学式为_____________________;
(3)铁生锈的次要过程:

写出Fe转化为FeCO3总反应的化学方程式_____________________;
(4)为防止铁生锈,可对铁制品进行“烤蓝”处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21: 8)保护膜,该氧化物的化学式为_____________________;
(二)废铁的再利用
硫酸铁在农业可用作肥料,是花木,果树制造叶绿素的催化剂。用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备硫酸铁的主要流程如下:
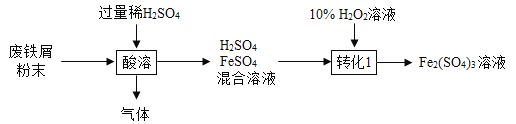
(1)将废铁屑研磨成粉末的目的是_____________________;
(2)“酸溶” 时H2SO4与FeCO3反应生成一种常见气体,反应的化学方程式为_____。
(3)“转化”过程中发生反应的化学方程式为_____________________。反应时温度不宜过高的原因是_____________________;
(三) CH4还原Fe2O3的探究
取40.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。
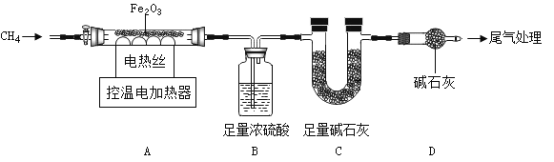
资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.②
(I)装配好实验装置后,先要_____________________;
(2) A中反应: 。下列说法正确的是_____________________;(选填序号)。
。下列说法正确的是_____________________;(选填序号)。
a x:y=1:2
b 装置B、C增加的质量比为9:11
(3)控温加热 一段时间后,继续通CH4至冷却,A中剩余的32.0g 固体为Fe和FeO的混合物。在剩余固体中加一定量稀硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为_____________________g.
②剩余固体和稀硫酸完全反应形成FeSO4的质量为_____________________g.
-
铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为______。
(2)铁锈主要成分是Fe2O3•nH2O ,铁生锈主要与空气中的______有关。
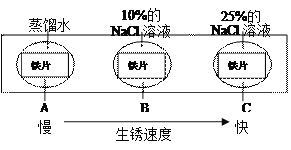
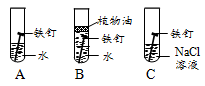
(3)如图实验说明NaCl在铁生锈中的作用是______。
(4)铁生锈的次要过程:

写出Fe转化为FeCO3总反应的化学方程式______。
(5)为防止铁生锈,可对铁制品进行“发蓝”处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为______。
(二)废铁的再利用
黄钠铁矾[NaFex(SO4)y(OH)z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备黄钠铁矾的主要流程如下:

(1)将废铁屑研磨成粉末的目的是______。
(2)“酸溶”时H2SO4与Fe、FeCO3反应,还发生的化学方程式有______和Fe+Fe2(SO4)3=3FeSO4。
(3)“转化1”发生反应的化学方程式为______。反应时温度不宜过高的原因是______。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用下图装置进行热分解实验。
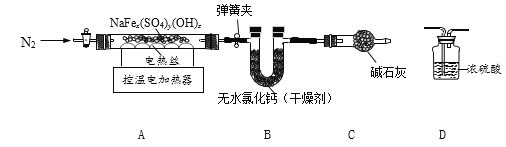
(资料)①NaFex(SO4)y(OH)z在T1℃分解会生成H2O(气态),提高温度至T2℃继续分解产生SO3气体,并得到Fe203和Na2SO4。
②浓硫酸可用于吸收SO3。
(1)装配好实验装置后,先要______。
(2)分别控制温度在T1℃、T2℃对A中固体加热。
①控制温度在T1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T2℃,加热至反应完全。
③T1℃、T2℃时,加热后均通入一段时间N2,目的是______。
(3)完全反应后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFex(SO4)y(OH)z中,x:y:z=_______。
反思:若该实验过程中缺少C装置,则x:z的值____(选填“偏大”、“偏小”或“不变”)。
-
目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)铁的广泛应用
某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为 。
(二)铁锈成分的探究
(1)右图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是 (选填序号)。
(2).铁生锈的主要过程为:Fe  Fe(OH)2
Fe(OH)2  Fe(OH)3
Fe(OH)3  Fe2O3·xH2O
Fe2O3·xH2O
次要过程为:Fe  FeCO3
FeCO3
写出Fe  Fe(OH)2反应的化学方程式 。
Fe(OH)2反应的化学方程式 。
(3).铁锈组成成分的确定
某铁锈成分为Fe2O3·xH2O和FeCO3。为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。
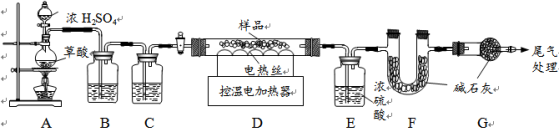
【查阅资料】①Fe2O3·xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2。②温度高于500℃时铁的氧化物才能被CO还原。③碱石灰的主要成分是氢氧化钠和氧化钙。
①装配好实验装置后,首先要 。
②装置A中的反应为:H2C2O4 (草酸)  CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。
则样品中FeCO3的质量m(FeCO3)= g,x= 。
④若缺少G装置,测得的m(FeCO3) (选填“偏大”、“偏小”、“不变”,下同),
x的值会 。
(三)炼铁过程的探究
⑴.写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式 。
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO Fe+CO2
Fe+CO2
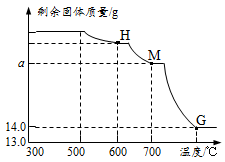
⑵.将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼
铁过程的探究。加热时测定D中剩余固体质量随温度变化的曲线如右图所示。图中M点对应的a= 。
-
(6分)铁是生产、生活中应用广泛的金属材料。
(1)在酱油中加入铁强化剂,可预防 (填“佝偻病”、“贫血”或“骨质疏松”)。
(2)某种含铁粉的麦片,食用后在胃酸(盐酸)作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。
(3)对铁质零件进行“发蓝”处理后,其表面会形成致密氧化膜,从而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是________________。
②为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,由此可知“发蓝”处理效果不好,因为________________(用化学方程式表示)。
(4)某同学对X、银、铜、铁四种金属混合物的成分进行探究,流程如下:
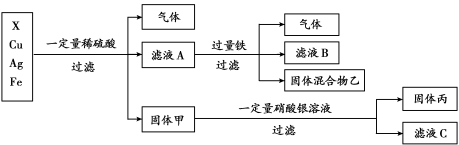
①四种金属的活动性由强到弱的顺序是 。
②固体丙的组成可能是 。
-
我国是一个钢铁大国,钢铁产量为世界第一。请回答下列问题:
(1)加铁麦片中含微量铁粉,食用后可与胃酸(主要成分是盐酸)反应转化成可被人体吸收的亚铁离子,亚铁离子符号为______________。反应的化学方程式为_____________。
(2)某兴趣小组的同学用图一实验模拟炼铁。一段时间后,观察到A处红棕色固体全部变为黑色,反应的化学方程式_____________。
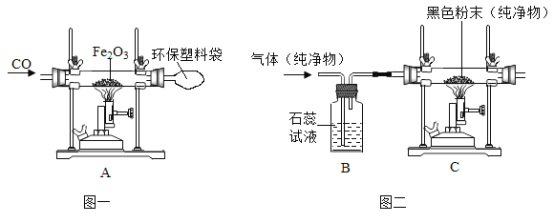
(3)检验A处产物是否只有铁
①初步检验:用物理方法证明A处产物有铁,操作及现象为_____________。
②进一步验证:取A处的产物样品于试管中,加入足量的硫酸铜溶液,发现只有部分变红。写出生成红色物质的化学方程式_____________,说明 A处产物只有部分是铁。
(4)工业生产中,若用490万吨含氧化铁60%的赤铁矿炼铁,得到含杂质4%的生铁。计算:
③赤铁矿中含氧化铁的质量为_____________万吨。
④得到含杂质4%的生铁质量为_____________万吨(结果精确到0.1)。
(5)改进模拟炼铁的装置进行实验,探究气体及黑色粉末成分(如图二)。当某纯净气体通过C装置发生化学反应时,观察到B、C处现象如下:
⑤若B处石蕊试液不变色,C处无明显实验现象,则C处的黑色粉末是_____________。
⑥若B处石蕊试液变成红色,C处固体减少,则C处发生反应的化学方程式是_____________。
(6)通过学习知道,铁与_____________同时接触易生锈。请你写出防止车船表面锈蚀的具体做法_____________。
-
青少年处于生长发育期容易产生缺铁性贫血,可以补铁的方式很多,市售麦片中含有微量极细的铁粉,饮用这种麦片后,铁在胃液中与胃酸的主要成分盐酸(可用HCl表示)反应,生成氯化亚铁和氢气.
(1)写出该反应的化学方程式:________;
(2)缺铁性贫血中的“铁”是指________(填序号);
A.铁单质 B.铁原子 C.铁元素 D.铁分子
(3)已知有元素化合价升降的反应是氧化还原反应,元素化合价升高的物质被氧化.在上述反应中,化合价发生变化的元素有________(填元素符号),被氧化的物质是________(填化学式).
-
如果血液中缺乏亚铁离子,就会造成缺铁性贫血.市场出售的某种麦片中,含有微量的颗粒极细小的还原铁粉.这些铁粉在人体胃液(胃酸的主要成分是HCl)作用下转化成亚铁盐,这个转化的化学方程式是________.
-
某同学近来脸色偏黄,经医生诊断患有缺铁性贫血症,需服用市场上出售的某种麦片,其中含有微量颗粒的还原铁粉,这些铁粉在人体胃酸的作用下可转化成氯化亚铁,该转化的化学方程式为________,该反应属于________反应;请你从有关资料上查阅补铁的食物如:________、________;从超市所售的物品中补铁的有________、________;请你谈谈偏食对人体的健康有何影响?
-
如果血液中缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某麦片中含有微量的颗粒细小的还原铁粉。这些铁粉在人体胃液中可能转化为人体所需的亚铁离子,写出这个反应的化学方程式________。(胃液中含盐酸)
-
金属在日常生活中都有较广泛的应用.
如:(1)镁在空气中燃烧时,能发出耀眼的白光,可用来制造镁闪光灯,其反应的化学方程式为:________.
(2)市场上出售的补血麦片中含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸反应转化为亚铁盐,起到补血的作用,写出这个反应的化学方程式:________.
(3)金属与金属的化合物溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来,如铁和硫酸铜溶液反应,其化学方程式为________.
(4)赤铁矿(主要成分为Fe2O3 )在高炉里反应生成单质铁的化学方程式是________.
。 x的化学式为_____________________;


。下列说法正确的是_____________________;(选填序号)。







