-
过氧化钙(CaO2)在生产中具有广泛的应用
(一)过氧化钙的性质与用途
(1)CaO2能与稀盐酸发生复分解反应,反应的化学方程式为_____。
(2)鱼类长途运输的增氧剂的主要成分为CaO2,它与水缓慢反应生成O2,还生成一种碱,其化学式为_____,Na2O2也能与水反应,原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析可能的原因_____。
(二)过氧化钙晶体的制备
(资料)过氧化钙晶体(CaO2·yH2O),常温为白色,能溶于酸,难溶于酒精。
制备原理:CaCl2+H2O2+NH3+H2O→CaO2·yH2O↓+NH4Cl,装置如下。
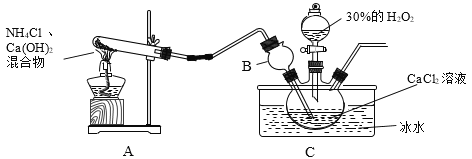
(1)装置A中试管内发生反应的化学方程式为_____。
(2)装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ._____。
(3)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。
①洗涤时采用95%的酒精溶液洗涤的优点是_____。
②检验晶体已洗涤干净的方法为_____。
(三)过氧化钙晶体组成的测定
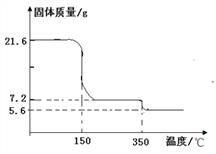
称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),
(1)0—150℃质量不发生改变的原因是_____。
(2)根据如图可知y=_____。(写出计算过程)
(3)350℃时发生反应的化学方程式为_____。
-
过氧化钙(CaO2)在生产中具有广泛的应用
(一)过氧化钙的性质与用途
(1)CaO2能与稀盐酸发生复分解反应,反应的化学方程式为_____。
(2)鱼类长途运输的增氧剂的主要成分为CaO2,它与水缓慢反应生成O2,还生成一种碱,其化学式为_____,Na2O2也能与水反应,原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析可能的原因_____。
(二)过氧化钙晶体的制备
(资料)过氧化钙晶体(CaO2·yH2O),常温为白色,能溶于酸,难溶于酒精。
制备原理:CaCl2+H2O2+NH3+H2O→CaO2·yH2O↓+NH4Cl,装置如下。
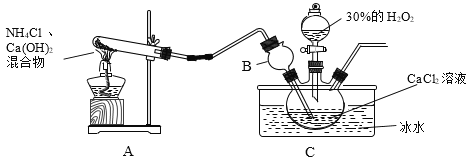
(1)装置A中试管内发生反应的化学方程式为_____。
(2)装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ._____。
(3)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。
①洗涤时采用95%的酒精溶液洗涤的优点是_____。
②检验晶体已洗涤干净的方法为_____。
(三)过氧化钙晶体组成的测定
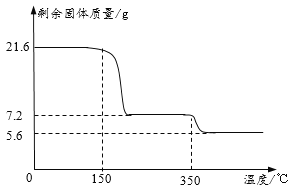
称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),

(1)0—150℃质量不发生改变的原因是_____。
(2)根据如图可知y=_____。(写出计算过程)
(3)350℃时发生反应的化学方程式为_____。
-
过氧化钙(CaO2)在生产中具有广泛的应用
(一)过氧化钙的性质与用途
鱼类长途运输的增氧剂的主要成分为CaO2,它与水缓慢反应生成O2,还生成一种碱,其化学式为_______,Na2O2也能与水反应,原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析可能的原因________。
(二)过氧化钙晶体的制备
(资料)过氧化钙晶体(CaO2·yH2O),常温为白色,能溶于酸,难溶于酒精。制备原理:CaCl2+H2O2+NH3+H2O CaO2·yH2O↓+NH4Cl,装置如下。
CaO2·yH2O↓+NH4Cl,装置如下。
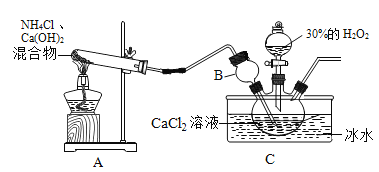
(1)装置A中试管内发生反应的化学方程式为____
(2)B装置的作用是______。
(3)装置C需要控制温度在0℃左右,采用的简单易行的办法是____,控制温度在0℃左右可能的原因主要有:
Ⅰ该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ______。
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。
①洗涤时采用95%的酒精溶液洗涤的优点是______。
②检验晶体已洗涤干净的试剂为________。
(三)过氧化钙晶体组成的测定
称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水)
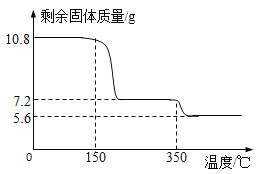
(1)0—150℃质量不发生改变的原因是__________。
(2)根据图可知y = ____。(写出计算过程)
(3)350℃时发生反应的化学方程式为________。
-
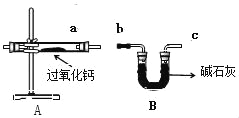
过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑
(实验探究)
| 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 1、向玻璃管中加入过氧化钙,将A左侧管口换成无孔塞,加热到315℃,并保持一段时间直至完全反应,用带火星的木条放在a导管口 | 木条复燃 | 有 _____生成 |
| 2、待玻璃管冷却,取管中少量白色固体,①加适量水充分搅拌;②滴几滴酚酞试液 | ① _____②变红色 | 固体是氧化钙 |
| 实验二 | 1、换装过氧化钙,将A左侧管口换成单孔塞,连接a,b导管,通入二氧化碳气体充分反应,同时把带火星的木条放在c导管口。 | 木条复燃,固体仍是白色 | |
| 2、取适量玻璃管中白色固体,_____。 | _____ | 固体是碳酸钙 |
(解释与结论)
(1)由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
(2)由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:_____。
(3)B装置中碱石灰的作用是:_____
(分析与计算)
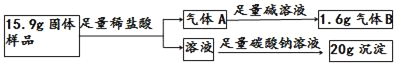
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为_____。
-
过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如下图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑

(实验探究)

________________ ___________________ ________________ ____________
(解释与结论)
⑴由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
⑵由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:________。
⑶B装置中碱石灰的作用是:_________
(分析与计算)
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为 _______。
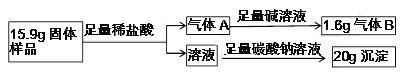
-
过氧化钙晶体(CaO2·nH2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
l.过氧化钙晶体(CaO2·nH2O)的制备
实验室制备过氧化钙晶体反应方程式为CaCl2+H2O2+2NH3+nH2O=CaO2・nH2O+2NH4Cl,实验装置如图。
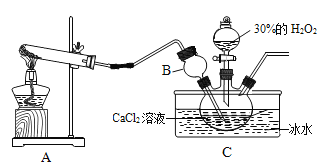
(1)装置A中生成的气体为______。
(2)装置B的作用是________。
(3)装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
①该反应是放热反应,温度低有利于提高CaO2・nH2O产率;
②____。
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2・nH2O。检验晶体已洗涤干净的方法为______。
Ⅱ.过氧化钙晶体(CaO2・nH2O)中n的测定
资料:CaO2・nH2O加热至120℃完全失去结晶水,继续加热至350℃,剩余固体受热分解放出O2;
(5)某兴趣小组称取2.16g CaO2・nH2O样品,用热分析仪对其进行热分解实验,测得剩余固体的质量随温度变化曲线如图所示
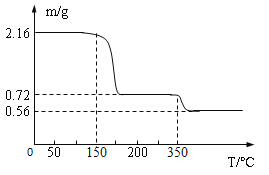
①CaO2・nH2O中n的值为____。(写出计算过程)
②350℃发生反应的化学方程式为_________。
③若过氧化钙品体中混有杂质(杂质不参加反应),会导致测得的n的值___(填“偏大”“偏小”或“不变”)。
Ⅲ.过氧化钙晶体(CaO2・nH2O)的性质研究
(6)该兴趣小组另称取少量CaO2・nH2O样品于试管中,加入适量的稀盐酸使样品完全反应,然后加入足量的Na2CO3溶液,看到_____现象,说明CaO2・nH2O与稀盐酸反应生成了CaCl2。
-
过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域,特别是鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,在容器内满足下列条件才能保持鱼存活:充足的氧气;及时除去鱼呼出的CO2,容器中的水要呈弱碱性。加入过氧化钙后,就可以解决这些问题。
(1)过氧化钙(CaO2)中的氧元素的化合价为_____。
(2)过氧化钙的供氧原理是过氧化钙可以与水反应生成氧气和氢氧化钙,请写出过氧化钙与水反应的化学方程式_____。
(3)小明想在实验室用过氧化钙固体与水反应制取氧气。实验过程中发现过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速咸缓”,原因可能是_____。
(4)如图是以大理石(含A12O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图
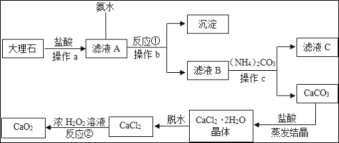
①操作a、b、c的名称都为_____。
②从滤液C中可回收的副产品的化学式为_____,属于_____肥。
③写出反应①的化学方程式_____。
④反应②是在低温下往过氧化氢浓溶液中投入无水氯化钙进行反应,该反应的化学方程式为_____,基本反类型是_____。
⑤在该生产过程中,用110kg的大理石制得了72kg的过氧化钙,如果不考虑过程中的损耗可计算出大理石中CaCO3的质量分数为_____(结果保留一位小数)
-
过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域,特别是鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,在容器内满足下列条件才能保持鱼存活:充足的氧气;及时除去鱼呼出的CO2,容器中的水要呈弱碱性。加入过氧化钙后,就可以解决这些问题。
(1)过氧化钙(CaO2)中的氧元素的化合价为_____。
(2)过氧化钙的供氧原理是过氧化钙可以与水反应生成氧气和氢氧化钙,请写出过氧化钙与水反应的化学方程式_____。
(3)小明想在实验室用过氧化钙固体与水反应制取氧气。实验过程中发现过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速咸缓”,原因可能是_____。
(4)如图是以大理石(含A12O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图

①操作a、b、c的名称都为_____。
②从滤液C中可回收的副产品的化学式为_____,属于_____肥。
③写出反应①的化学方程式_____。
④反应②是在低温下往过氧化氢浓溶液中投入无水氯化钙进行反应,该反应的化学方程式为_____,基本反类型是_____。
⑤在该生产过程中,用110kg的大理石制得了72kg的过氧化钙,如果不考虑过程中的损耗可计算出大理石中CaCO3的质量分数为_____(结果保留一位小数)
-
过氧化钙晶体(化学式为:CaO2·yH2O,化学式中的“yH2O”称为结晶水),常温该晶体下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1) 过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+NH3+H2O CaO2·yH2O↓+NH4Cl。
CaO2·yH2O↓+NH4Cl。
用如下制取装置制备过氧化钙晶体。
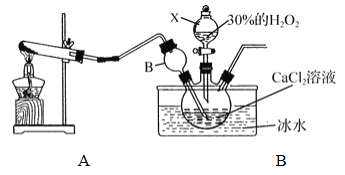
①装置A中生成的气体为________,此装置在初中化学实验中可用于制取_______(填某气体);仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. ____________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。检验晶体已洗涤干净的方法为:取最后一次洗涤液,滴加____________,若__________,则晶体已经洗涤干净。
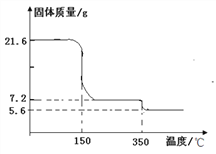
(2)为确定过氧化钙晶体的组成,某化学兴趣小组称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),根据下图可知y=_______, 350℃时发生的分解反应方程式为_______________。
-
过氧化钙晶体(化学式为:CaO2·yH2O,化学式中的“yH2O”称为结晶水),常温该晶体下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1) 过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+NH3+H2O CaO2·yH2O↓+NH4Cl。
CaO2·yH2O↓+NH4Cl。
用如下制取装置制备过氧化钙晶体。
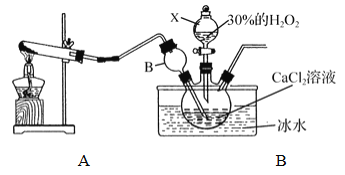
①装置A中生成的气体为________,此装置在初中化学实验中可用于制取_______(填某气体);仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. ____________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。检验晶体已洗涤干净的方法为:取最后一次洗涤液,滴加____________,若__________,则晶体已经洗涤干净。
(2)为确定过氧化钙晶体的组成,某化学兴趣小组称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),根据下图可知y=_______, 350℃时发生的分解反应方程式为_______________。