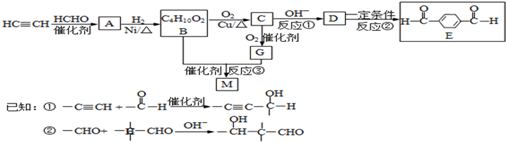
-
为了降低PM2.5的浓度,2013年上海的汽油将实行“欧Ⅴ”标准,即A元素的含量要小于10ppm(百万分比浓度),汽油中A常以C2H5AH的形式存在。则“A”元素是指
A.硫 B.氮 C.碳 D.氢
难度: 简单查看答案及解析
-
符号“3p”没有给出的信息是
A.能级 B.电子层 C.电子亚层 D.电子云在空间的伸展方向
难度: 简单查看答案及解析
-
以下物质在空气中不会发生自燃的是
A.P4 B.PH3 C.SiH4 D.Na
难度: 中等查看答案及解析
-
下列有关高级脂肪酸的叙述中错误的是
A.都不溶于水 B.都为固态 C.都比水轻 D.其钠盐是肥皂的主要成分
难度: 中等查看答案及解析
-
相对原子质量原来以16O原子质量的十六分之一为标准,现在以12C原子质量的十二分之一为标准,二者相差0.0043%。这两种标准中数值相同的是
A.14N的质量数 B.氕原子的相对质量
C.氯元素的相对原子质量 D.氟化钠的摩尔质量
难度: 中等查看答案及解析
-
原子个数相同、核外电子数相同的分子(离子)的空间构型相同。以下微粒为三角锥形的是
A.NH4+ B.H3O+ C.H2S D.CH4
难度: 中等查看答案及解析
-
以下物质的实验室制备不合理的是
A.用铅皿制备HF B.用浓硫酸制备HI
C.用磨砂接口的装置制备HNO3 D.用饱和食盐水代替水制备乙炔
难度: 中等查看答案及解析
-
常压下,苯的沸点低于甲苯,熔点却高于甲苯。苯的熔点更高的原因可能是
A.苯具有芳香性 B.苯中的化学键强度更强
C.苯分子间作用力更小 D.固态时苯分子排列更紧密
难度: 中等查看答案及解析
-
如图,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是
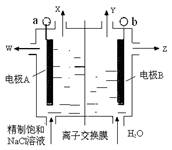
A.精制饱和氯化钠溶液从阳极区补充
B.产品烧碱溶液从阴极区流出
C.产品烧碱比未用离子交换膜时更纯
D.每转移NA个电子理论上可生成0.5mol 烧碱
难度: 中等查看答案及解析
-
以下既有反应热又有溶解热且都是吸热的是
A.浓硫酸与NaOH溶液 B.KNO3加入水中
C.NH4NO3加入水中 D.CaO加入水中
难度: 中等查看答案及解析
-
呋喃甲醛(即糠醛)的结构简式如图,其由碳原子和氧原子构成的环,性质类似于苯环,即具有“芳香性”。则关于糠醛的叙述错误的是
A.分子中没有C=C键 B.不能被酸性高锰酸钾溶液氧化
C.能生成呋喃甲醇 D.能与苯酚制备糠醛树脂
难度: 中等查看答案及解析
-
以下所用试剂错误的是
A.清洗做完焰色反应的铂丝——稀盐酸
B.干燥CO气体——浓硫酸
C.洗去附着在试管内壁的硫——热NaOH溶液
D.洗去附着在试管内壁的氯化银——稀硝酸
难度: 中等查看答案及解析
-
液氨和水类似,也能电离:NH3+NH3
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
A.c(Na+) = c(NH2-) B.c (NH4+)=1×10-29mol/L
C.c(NH2-) > c (NH4+) D.c(NH4+)∙c(NH2-) = l.0×l0-30
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论可靠的是
选项 实验操作 实验现象 结 论
A 分别测定0.1mol/LNa2CO3和苯酚钠溶液的pH 前者pH比后者的大 酸性:苯酚>碳酸
B 向无色溶液A中加入稀硫酸 产生淡黄色沉淀和无色气体 A中含S2O32-离子
C CuSO4和H2SO4混合溶液中加入Zn 锌表面附着红色物质;产生无色气体 氧化性:Cu2+>H+
D 向0.01mol/L的KCl、KI混合液中滴加AgNO3溶液 先出现黄色沉淀 溶解出Ag+的能力:AgCl > AgI
难度: 中等查看答案及解析
-
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是
A.NaCl和O2 B.NaClO3和NaClO C.NaClO3和Cl2 D.NaClO3和NaCl
难度: 中等查看答案及解析
-
某硝石(主要成分是NaNO3)除去不溶性杂质后,其溶液中还含有NaCl、Ca(HCO3)2,实验室提纯NaNO3溶液时,往溶液中依次加入过量的NaOH、AgNO3、Na2CO3,过滤后再加入适量硝酸。以上过程发生5个离子反应,以下4个离子方程式中不符合反应事实的是
A.Ca2++HCO3-+OH-→ CaCO3↓+H2O B.Ag++OH-→AgOH↓
C.2Ag++CO32-→Ag2CO3↓ D.CO32-+2H+→ CO2↑+H2O
难度: 中等查看答案及解析
-
有KCl、NaCl、Na2CO3 的混合物,其中钠元素的质量分数为31.5%,氯元素的质量分数为27.08%,则Na2CO3 的质量分数约为
A.38% B.50% C.75% D.80%
难度: 中等查看答案及解析
-
与CaC2一样,Mg3C2也是离子晶体,与水能发生复分解反应。关于Mg3C2的叙述正确的是
A.与水反应有乙炔生成 B.与水反应有Mg(OH)2生成
C.有C-C键 D.有C22-离子
难度: 中等查看答案及解析
-
下列关于SO2性质的分析,肯定错误的是
A.通入Ca(ClO)2溶液中,有HClO生成 B.通入FeCl3溶液中,有SO42-生成
C.通入氯水中,有淡黄色沉淀生成 D.通入KICl2溶液中,有I-生成
难度: 中等查看答案及解析
-
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
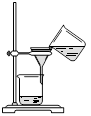
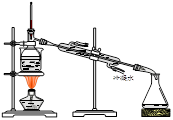
A.海带灼烧成灰 B.过滤得含I-溶液 C.放出碘的苯溶液 D.分离碘并回收苯
难度: 中等查看答案及解析
-
某固体混合物可能含有NH4Cl、KOH、AgNO3、A1C13中的若干种,进行如下实验:
(1)加足量水溶解得澄清溶液
(2)往溶液中加入稀硝酸立即产生白色沉淀,加至过量,未见沉淀溶解根据上述实验,以下推断错误的是
A.A1C13可能存在 B.澄清溶液呈无色
C.Ag (NH3)2+会在酸中离解 D.澄清溶液中c (OH-)>c (Cl-)
难度: 中等查看答案及解析
-
由甘氨酸(分子式:C2H5NO2)、丙氨酸(C3H7NO2)、苯丙氨酸(C9H11NO2)、谷氨酸(C5H9NO4)各若干,通过分子间脱去9分子水缩合而生成的十肽,其分子式为C48H64N10O19,则对参加反应的各氨基酸分子数的分析正确的是
A.有不止一组数据 B.谷氨酸为4分子
C.苯丙氨酸不能为3分子 D.丙氨酸为3分子
难度: 中等查看答案及解析