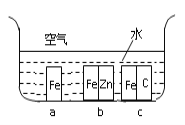
-
2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).
A.使用光催化剂不改变反应速率 B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率 D.改变压强对反应速率无影响
难度: 简单查看答案及解析
-
CCUS技术是将生产过程中排放的二氧化碳收集起来,进行提纯,继而加以合理利用的一项新技术。下列属于CCUS技术的是
A.将二氧化碳埋到地下,进行地质封存
B.用海水吸收CO2,形成碳酸钙永久沉积
C.二氧化碳通入盐碱湖里,生成矿物盐封存
D.用二氧化碳生产可降解的聚碳酸酯塑料
难度: 简单查看答案及解析
-
下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,
不变
B.常温下,0.01mol·L-1Ba(OH)2溶液pH为12
C.常温下,CH3COOH稀溶液中加水稀释,则
减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且
的值增大
难度: 简单查看答案及解析
-
反应A(g)+2B(g)=C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
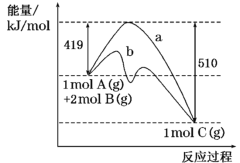
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.曲线b表示使用催化剂后的能量变化
D.该反应的焓变
H= -510 kJ·mol-1
难度: 简单查看答案及解析
-
下列事实中,能说明HNO2是弱电解质的是
A.用HNO2溶液做导电性实验,灯泡较暗
B.HNO2是共价化合物
C.HNO2溶液不与NaCl反应
D.室温下,0.1mol·L-1HNO2溶液的pH为2.15
难度: 中等查看答案及解析
-
H2CO3和H2S在25 ℃时的电离常数如下:
电离常数
K1
K2
H2CO3
4.2×10-7
5.6×10-11
H2S
5.7×10-8
1.2×10-15
则下列反应可能发生的是( )
A.NaHCO3+NaHS===Na2CO3+H2S B.H2S+Na2CO3===NaHS+NaHCO3
C.Na2S+H2O+CO2===H2S+Na2CO3 D.H2S+NaHCO3===NaHS+H2CO3
难度: 困难查看答案及解析
-
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有Cl-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、I- B.Br-、Cl-、I-
C.I-、Br-、Cl- D.Br-、I-、Cl-
难度: 中等查看答案及解析
-
甲烷重整时涉及以下两个反应
① CH4(g) + H2O(g)
CO(g) +3H2(g) 平衡常数K1
② CO (g) + H2O(g)
CO2(g) + H2(g) 平衡常数K2
它们的平衡常数随温度的变化如图所示,下列说法正确的是( )

A.反应①、②都是放热反应
B.两曲线交点表示此时①、②两反应速率相等
C.相同温度下,CH4(g)+2H2O(g)
CO2(g) +4H2(g)的平衡常数为K1+K2
D.相同条件下,增大反应①、②中水蒸气的浓度,CH4、CO的转化率均增大
难度: 中等查看答案及解析