-
某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
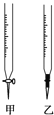
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 |
| 滴定前读数(/mL) | 滴定后读数(/mL) |
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。
-
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
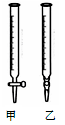
(1)操作F中应该选择图中 ______ 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 ______ .若指示剂改为甲基橙则颜色的变化是 ______。
(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL |
| 滴定前刻度 | 滴定后刻度 |
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.59 |
| | | | |
滴定中误差较大的是第 ______ 次实验,造成这种误差的可能原因是 ______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为______mol/L。
-
某学生用0.1000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.取标准NaOH容液注入碱式滴定管至刻度线0以上2cm~3cm;
B.量取25.00mL.待制盐酸溶液注入洁净的锥形瓶,并加儒2~3滴酚酞;
C.用标准溶液润洗滴定管2~3次;
D.调节液面至“0”或“0”以下刻度并记下读数;
E.把盛有标准溶液的碱式滴定管周定好,调节滴定管尖嘴使之充满溶液;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度。
据此实验光成填空:
(1)正确操作步骤的顺序是__、__、__、__、B、__。(用序号字母填写)
(2)滴定管洗涤之前必须___,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视___,滴定达到终点的标志是___。
(3)上述B步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是___(填“偏大”“偏小”或“不变”)。
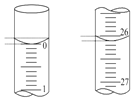
(4)若第四次滴定开始和结束时,滴定管中的液面如图所示;则所滴NaOH溶液的体积为___mL。
(5)某学生根据四次实验记录数据计算该盐酸溶液的物质的量浓度:c(HCl)=___。
| 滴定次数 | 盐酸(mL) | 0.1000mol/LNaOH的体积(mL) |
| 滴定前 | 滴定后 | 溶液体积 |
| 第一次 | 25.00 | 0.05 | 26.17 | 26.12 |
| 第二次 | 25.00 | 1.58 | 30.31 | 28.73 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
-
(12分)某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B用标准NaOH溶液润洗滴定管2~3次
C把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的 (选填:“甲”、“乙”)。
(2)正确的操作顺序是 (填字母序号)。
(3)上述B步操作的目的是 。
(4)判断到达滴定终点的实验现象是 。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是 (填“偏大”或“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 |
| 滴定前读数(/mL) | 滴定后读数(/mL) |
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| | | |
试计算待测盐酸的物质的量浓度(列出计算过程)。
-
(7分)、某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:(1)以上步骤有错误的是(填编号)________,
该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) ______________;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)____________________ ;
(3)判断滴定终点的现象是:锥形瓶中溶液从 ________色变为________色,且半分钟不变色;
(4)右图是某次滴定时的滴定管中的液面,其读数为 ________mL;
(5)根据下列数据:请计算待测盐酸溶液的浓度:________ mol/L。
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) |
| 滴定前读数 | 滴定后读数 |
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
-
(11分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。 请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 ________色变为 色,且半分钟不变色。
(4)图19是某次滴定时的滴定管中的液面,其读数为 ________mL
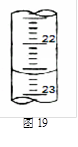
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol/L
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) |
| 滴定前读数(mL) | 滴定后读数(mL) |
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
-
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ________,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是: ________
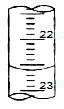
(4)下图是某次滴定时的滴定管中的液面,其读数为 ________mL
-
某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
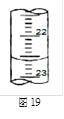
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
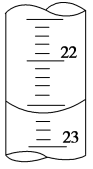
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) |
| 滴定前读数 | 滴定后读数 |
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
| | | |
-
(Ⅰ)某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20 .00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果(填“偏大”、“偏小”或“无影响”)________。
(3)判断滴定终点的现象是:_________________________________________________。
(Ⅱ).室温时,pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(4)如果加入蒸馏水,应加_________mL;
(5)如果加入pH=10的NaOH溶液,应加_________mL;
(6)如果加0.01mol/L HCl,应加_________mL。
-
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)________;
(3)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟不变色;
(4)右图是某次滴定时的滴定管中的液面,其读数为________mL;
(5)根据下列数据:请计算待测盐酸溶液的浓度:________ mol/L.
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) |
| 滴定前读数 | 滴定后读数 |
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |









