-
(12分)某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B用标准NaOH溶液润洗滴定管2~3次
C把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
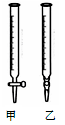
(1)下图中属于碱式滴定管的 (选填:“甲”、“乙”)。
(2)正确的操作顺序是 (填字母序号)。
(3)上述B步操作的目的是 。
(4)判断到达滴定终点的实验现象是 。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是 (填“偏大”或“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 |
| 滴定前读数(/mL) | 滴定后读数(/mL) |
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| | | |
试计算待测盐酸的物质的量浓度(列出计算过程)。
-
某学生用0.1000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.取标准NaOH容液注入碱式滴定管至刻度线0以上2cm~3cm;
B.量取25.00mL.待制盐酸溶液注入洁净的锥形瓶,并加儒2~3滴酚酞;
C.用标准溶液润洗滴定管2~3次;
D.调节液面至“0”或“0”以下刻度并记下读数;
E.把盛有标准溶液的碱式滴定管周定好,调节滴定管尖嘴使之充满溶液;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度。
据此实验光成填空:
(1)正确操作步骤的顺序是__、__、__、__、B、__。(用序号字母填写)
(2)滴定管洗涤之前必须___,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视___,滴定达到终点的标志是___。
(3)上述B步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是___(填“偏大”“偏小”或“不变”)。
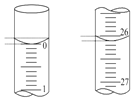
(4)若第四次滴定开始和结束时,滴定管中的液面如图所示;则所滴NaOH溶液的体积为___mL。
(5)某学生根据四次实验记录数据计算该盐酸溶液的物质的量浓度:c(HCl)=___。
| 滴定次数 | 盐酸(mL) | 0.1000mol/LNaOH的体积(mL) |
| 滴定前 | 滴定后 | 溶液体积 |
| 第一次 | 25.00 | 0.05 | 26.17 | 26.12 |
| 第二次 | 25.00 | 1.58 | 30.31 | 28.73 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
-
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
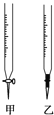
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 ______ 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 ______ .若指示剂改为甲基橙则颜色的变化是 ______。
(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL |
| 滴定前刻度 | 滴定后刻度 |
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.59 |
| | | | |
滴定中误差较大的是第 ______ 次实验,造成这种误差的可能原因是 ______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为______mol/L。
-
(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0 mol·L-1NaOH的体积(mL) |
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) |
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
| | | | |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
-
某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测溶液的体积(mL) | 0.100 0 mol·L-1NaOH的体积(mL) |
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) |
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为__________
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高(填序号)(_____)
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定 B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
-
用标准盐酸溶液滴定未知浓度的NaOH溶液,所测数据如下:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL |
| 滴定前刻度 | 滴定后刻度 |
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| | | |
测得NaOH溶液的物质的量浓度为
A. 0.0853mol/L B. 0.1000mol/L C. 0.0800mol/L D. 0.1250mol/L
-
某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。

(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL |
| 滴定前刻度 | 滴定后刻度 |
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
-
某学生用0.2 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、_______________、F(填序号)
(2)滴定结果如下:
| NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 20.20mL | 38.80mL |
根据以上数据可以计算出盐酸的物质的量浓度为_______________mol·L-1. (计算结果小数点后保留两位有效数字)
(3)达到滴定终点的标志是________________________________
(4)以下操作造成测定结果偏高的原因可能是___________________。
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
-
某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 |
| 滴定前读数(/mL) | 滴定后读数(/mL) |
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。
-
某学生用0.1000mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A. 取20.00mL待测盐酸溶液注入洁净的锥形瓶中并加入2~3滴酚酞试液
B. 用标准氢氧化钠溶液润洗滴定管2~3次
C. 把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管的尖嘴使之充满溶液
D. 取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E. 调节液面至“0” 或“0”刻度以下,记下读数
F. 把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、________________、F(填序号);
(2)上述B步骤的操作目的是________________。
(3)上述A步骤操作之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”、“偏小”或“无影响)。
(4)判断到达滴定终点的实验现象为________________。
(5)若滴定结束时,滴定管液面如图所示,则终点读数为_________mL。





