-
某学生用0.2 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、_______________、F(填序号)
(2)滴定结果如下:
NaOH起始读数
NaOH终点读数
第一次
0.10mL
18.60mL
第二次
20.20mL
38.80mL
根据以上数据可以计算出盐酸的物质的量浓度为_______________mol·L-1. (计算结果小数点后保留两位有效数字)
(3)达到滴定终点的标志是________________________________
(4)以下操作造成测定结果偏高的原因可能是___________________。
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
高二化学实验题简单题查看答案及解析
-
某学生用0.1000mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A. 取20.00mL待测盐酸溶液注入洁净的锥形瓶中并加入2~3滴酚酞试液
B. 用标准氢氧化钠溶液润洗滴定管2~3次
C. 把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管的尖嘴使之充满溶液
D. 取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E. 调节液面至“0” 或“0”刻度以下,记下读数
F. 把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、________________、F(填序号);
(2)上述B步骤的操作目的是________________。
(3)上述A步骤操作之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”、“偏小”或“无影响)。
(4)判断到达滴定终点的实验现象为________________。
(5)若滴定结束时,滴定管液面如图所示,则终点读数为_________mL。
高二化学实验题简单题查看答案及解析
-
某学生用0.1000mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A. 取20.00mL待测盐酸溶液注入洁净的锥形瓶中并加入2~3滴酚酞试液
B. 用标准氢氧化钠溶液润洗滴定管2~3次
C. 把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管的尖嘴使之充满溶液
D. 取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E. 调节液面至“0” 或“0”刻度以下,记下读数
F. 把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、________________、F(填序号);
(2)上述B步骤的操作目的是________________。
(3)上述A步骤操作之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”、“偏小”或“无影响)。
(4)判断到达滴定终点的实验现象为________________。
(5)若滴定结束时,滴定管液面如图所示,则终点读数为_________mL。
高二化学实验题简单题查看答案及解析
-
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题:

(1)正确的操作顺序是:B、________、F(填序号);
(2)上述B步骤操作的目的是________;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是________ (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是________;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为________mL。
(6)根据读数计算出该待测液的浓度为________。
高二化学实验题中等难度题查看答案及解析
-
(12分)某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。
回答下列问题:
(1)正确的操作顺序是:B、________、F(填序号);
(2)上述B步骤操作的目的是________;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是________ (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是________;
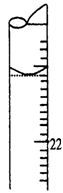
(5)若滴定结束时,滴定管液面如图所示,则终点读数为________mL。
(6)根据读数计算出该待测液的浓度为________。
高二化学填空题简单题查看答案及解析
-
(12分)某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。
回答下列问题:
(1)正确的操作顺序是:B、________、F(填序号);
(2)上述B步骤操作的目的是________;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是________ (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是________;
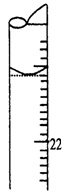
(5)若滴定结束时,滴定管液面如图所示,则终点读数为________mL。
(6)根据读数计算出该待测液的浓度为________。
高二化学填空题简单题查看答案及解析
-
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
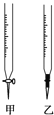
(1)操作F中应该选择图中 ______ 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 ______ .若指示剂改为甲基橙则颜色的变化是 ______。
(3)滴定结果如表所示:
滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
20
1.02
21.03
2
20
2.00
25.00
3
20
0.60
20.59
滴定中误差较大的是第 ______ 次实验,造成这种误差的可能原因是 ______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为______mol/L。
高二化学实验题困难题查看答案及解析
-
某学生用0.1032mol·L-1的盐酸标准溶液滴定未知浓度的KOH溶液,其操作分解为如下几步:
A.取已用蒸馏水洗净的酸式滴定管,用盐酸标准溶液润洗滴定管2~3次;
B.移取20 mL待测KOH注入洁净的锥形瓶中,并加入2~3滴甲基橙;
C.取标准盐酸溶液注入酸式滴定管至“0”刻度以上1~2 cm;
D.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液;
E.调节液面至“0”或“0”以下某一刻度,记录读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记录滴定管液面的刻度。
完成下列问题:
(1)上述操作步骤的正确顺序是__________________(填写字母序号)。
(2)判断溶液到达滴定终点的方法是_______________________。
(3)上述A步骤操作的目的是_____________________________。
(4)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是 ;若称取一定量的KOH固体(含少量NaOH)配制待测溶液并用上述盐酸标准溶液进行滴定,则对滴定结果产生的影响是_________,理由是 。
(5)用0.1032 mol·L-1的盐酸滴定未知浓度的KOH溶液,重复三次的实验数据如下表所示:
序号
消耗盐酸的体积/mL
待测KOH溶液的体积/mL
1
27.23
25.00
2
28.24
25.00
3
27.25
25.00
则待测KOH的物质的量浓度是________mol·L-1。
高二化学实验题困难题查看答案及解析
-
(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定
次数
待测溶液的体积(mL)
0.100 0 mol·L-1NaOH的体积(mL)
滴定前刻度
滴定后刻度
溶液体积(mL)
第一次
20.00
0.00
26.11
26.11
第二次
20.00
1.56
30.30
28.74
第三次
20.00
0.22
26.31
26.09
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
高二化学实验题中等难度题查看答案及解析
-
某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
待测溶液的体积(mL)
0.100 0 mol·L-1NaOH的体积(mL)
滴定前刻度
滴定后刻度
溶液体积(mL)
第一次
20.00
0.00
26.11
26.11
第二次
20.00
1.56
30.30
28.74
第三次
20.00
0.22
26.31
26.09
依据上表数据列式计算该盐酸溶液的物质的量浓度为__________
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高(填序号)(_____)
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定 B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
高二化学实验题中等难度题查看答案及解析