-
钛(Ti)被誉为第三金属,广泛应用于航空航天等领域。四氯化钛(TiCl4)是生产金属钛的重要原料,某小组设计实验制备四氯化钛并验证其产物CO,装置如下:
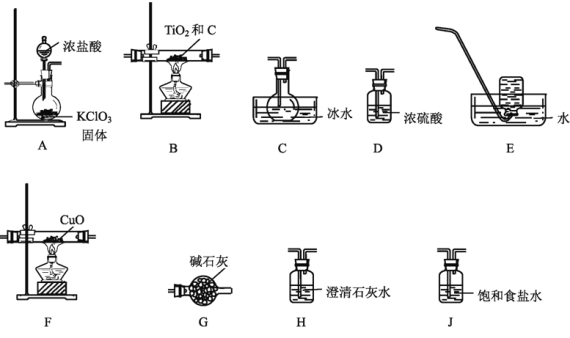
已知部分信息如下:
①制TiCl4的反应原理为:TiO2(S)+2C(s)+2Cl2(g)  TiCl4(g)+2CO(g) ②四氯化钛的熔、沸点分别为-24℃、136℃,易挥发,在水或淛湿空气中都极易水解,加热时能被O2氧化
TiCl4(g)+2CO(g) ②四氯化钛的熔、沸点分别为-24℃、136℃,易挥发,在水或淛湿空气中都极易水解,加热时能被O2氧化
回答下列问题:
(1)气流由左至右,装置的正确连接顺序为:A、______________________、H、E(填字母)。
(2)A中盛装盐酸的仪器名称是___________;G装置的作用是______________________。
(3)写出A中发生反应的化学方程式:______________________;实验室欲制备6720mLCl2(标准状态),则理论上应转移___________mol电子。
(4)能证明上述反应有CO生成的实验现象是______________________。
(5)利用图所示装置测定产品纯度:取 w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1的K2CrO4溶液作指示剂(注意:Ag2CrO4呈砖红色),用cmol·L-1AgNO3溶液滴定至终点,消耗滴定液VmL。[已知:常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12。TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl]
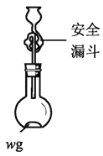
①安全漏斗在本实验中的作用除加水外,还有______________________。
②根据上述数据计算该产品的纯度为___________(用含w、c和V的代数式表示)。
-
钛被誉为“21世纪的金属”,在工农业生产、医疗、国防、科技等方面中有着极其广泛而重要的用途。四氯化钛是工业上制备金属钛的重要原料。在常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4的反应原理为:TiO2+2C+2Cl2 =TiCl4+2CO。
=TiCl4+2CO。
下图是实验室模拟工业生产制备四氯化钛的反应装置,其主要操作步骤有(顺序己打乱):
①连接好整套装置,并检査装置的气密性;
②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;
③将Ti02、炭粉混合均匀后,装入管式电炉中;
④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水;
⑤通入干燥的CO2气体并持续一段时间。
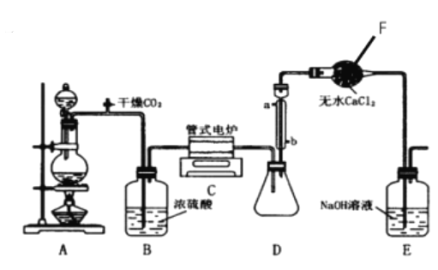
试回答:
(1)仪器F的名称是_______________,装罝A所用的试剂名称是_______________。
(2)正确的操作程序是(填写操作步骤的序号)______________________________。
(3)操作⑤的目的是______________________________。
(4)装置中冷凝管进水口的位置是(填a或b)_______________,装置E的作用_______________。
(5)将少量TiCl4露置于空气中,可能看到的现象是______________________________。
(6)利用化合物TiCl4可制备TiO2,请结合化学用语解释该过程:_______________。
-
环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
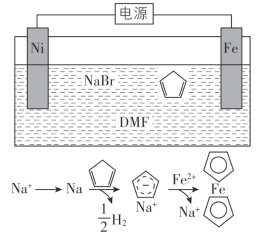
该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成
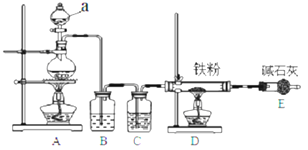
(1)某学习小组用如图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
①装置A 中仪器 a的名称是 ______ 。
②装置B的作用是 ______ ,C 中的试剂 ______ 。
③实验开始时先点燃 ______ 处酒精灯;装置 E的作用为 ______ 。
(2)工业上制备无水氯化铁的一种工艺流程如下:
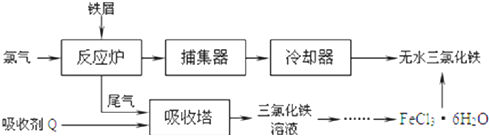
①吸收塔中发生反应的离子方程式为 ______
②简述由 晶体得到无水氯化铁的操作: ______
晶体得到无水氯化铁的操作: ______
-
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:

(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
一氯化碘 是一种重要的卤素互化物,在化工生产中有广泛应用。有关一氯化碘的部分信息如下:
是一种重要的卤素互化物,在化工生产中有广泛应用。有关一氯化碘的部分信息如下:

某小组拟设计实验制备一氯化碘并测定其纯度,装置如图所示。
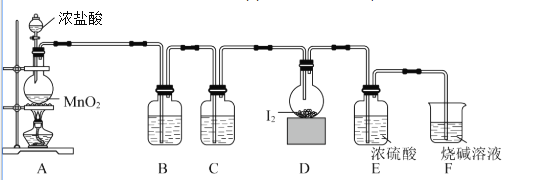
按如图所示装置进行实验,当D装置中产生红棕色液体、固体消失时停止反应。
请回答下列问题:
(1)盛装碘单质的仪器名称是_____________;E装置作用是_____________。
(2) 装置中试剂名称是______________________________。
装置中试剂名称是______________________________。
(3)写出A中反应的离子方程式______________________。
(4)启动反应后,将D装置的仪器放置于冷水浴中,其目的是__________________。
(5)粗产品中混有碘单质,提纯产品可选择下列装置中的_____________ 填字母
填字母 。
。
(6)测定产品纯度。取 该产品于锥形瓶,加入过量的KI溶液,充分反应。用
该产品于锥形瓶,加入过量的KI溶液,充分反应。用 溶液滴定
溶液滴定 有关反应:
有关反应: ,
, ,三次平行实验测得数据如下:
,三次平行实验测得数据如下:

该产品纯度为___________ 用含a和c的代数式表示
用含a和c的代数式表示 ;若产品中混有少量
;若产品中混有少量 ,测得结果_______________
,测得结果_______________ 填“偏高”“偏低”或“无影响”
填“偏高”“偏低”或“无影响” 。
。
-
锗是一种重要的战略资源,在半导体、航空航天测控等领域都有着广泛的应用。下图是以一种锗矿 主要成分为
主要成分为 、
、 、
、 为原料制备锗的工艺流程:
为原料制备锗的工艺流程:

已知:
 为两性氧化物。
为两性氧化物。
 “萃取”时用的萃取剂在本实验条件下对
“萃取”时用的萃取剂在本实验条件下对 有很好的选择性。
有很好的选择性。
 的熔、沸点分别为
的熔、沸点分别为 、
、 ,极易水解放热。
,极易水解放热。
 “蒸馏”过程中发生的反应为
“蒸馏”过程中发生的反应为 。
。
(1)锗在元素周期表中的位置为第_________周期第________族。
(2)“粉碎”的目的是_______________________。
(3)“焙烧”过程中 发生反应的化学方程式为________________。
发生反应的化学方程式为________________。
(4)“滤渣”的成分为________________ 填化学式
填化学式 ,“水相”中的阳离子除了
,“水相”中的阳离子除了 和
和 外,还有__________________
外,还有__________________ 填离子符号
填离子符号 。
。
(5)“萃取”时, 锗的萃取率
锗的萃取率 与
与 水相与有机相的体积比
水相与有机相的体积比 的关系如图所示,从生产成本的角度考虑,最适宜的
的关系如图所示,从生产成本的角度考虑,最适宜的 为______________
为______________ 填序号
填序号 。
。
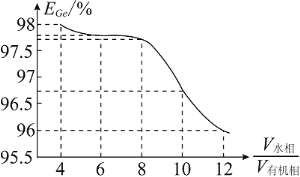




(6)“水解”时反应的化学方程式为_________________,该步实验操作必须在冰盐浴中进行的原因除了有利于水解反应正向进行外,还有______________。
(7)假设流程中每步都没有锗元素损失,若 锗
锗  含锗
含锗 经提纯得到
经提纯得到 的锗,则杂质元素的脱除率为_____________
的锗,则杂质元素的脱除率为_____________ 用含a、b、c的式子表示
用含a、b、c的式子表示 。
。 已知:杂质元素的脱除率
已知:杂质元素的脱除率
-
TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去);
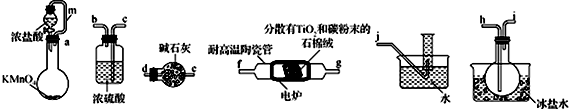
相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g • cm-3) | 水溶性 |
| TiCl4 | -25 | 136 | 1.5 | 易水解,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为_____________(填仪器接口字母)
(2)根据完整的实验装置进行实验,实验步骤如下:检査装置气密性后,装入药品;_____________
(按正确的顺序填入下列操作的字母)。
A.关闭分液漏斗活塞 B.停止加热,充分冷却
C.打开分液漏斗活塞 D.加热装置D中陶瓷管
实验时,当观察到______________时,开始进行步骤D。
(3)装置A中导管m的作用为_______________________。
(4)装置C的作用为 ___________________________________________。
(5)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________________________。
(6)设计实验证明装置 F中收集到的液体中含有TiCl4:______________________________________________。
(7)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_________________。
-
四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
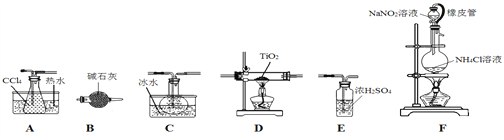
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) TiCl4(g)+CO2(g)。②反应条件:无水无氧且加热。
TiCl4(g)+CO2(g)。②反应条件:无水无氧且加热。
③有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | −23 | 76 | 与TiCl4互溶 |
| TiCl4 | −25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F橡皮管的作用是________________,装置F中有氮气生成,该反应的化学方程式为_______________。
(2)实验装置依次连接的顺序为F→B→_________________。
(3)实验开始前首先点燃____处酒精灯(填“D”或“F”),目的是___________________。
(4)E装置______(填“能”或“不能”)换成B装置,理由是______。
(5)欲分离C中的液态混合物,所采用操作的名称是__________________。
(6)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等。已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的铝元素: ___________________。
-
四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示:
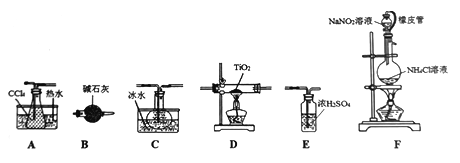
有关信息如下:
①反应原理:TiO2(s)+CCl4(g)  TiCl4(g)+CO2(g)。②反应条件:无水无氧且加热。
TiCl4(g)+CO2(g)。②反应条件:无水无氧且加热。
③有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F中有氮气生成,该反应的化学方程式为_________________________。
(2)实验装置依次连接的顺序为F→B→_____→ → → 。
(3)实验幵始前首先点燃________处酒精灯(填“D”或“P”),目的是________________。
(4) E装置不能换成B装置,理由是__________________________。
(5)欲分离C中的液态混合物,所采用操作的名称是____________________。
(6)TiCl4是制取取航天航空工业材料—一钛合金的重要原料。某钛合金的元素还有A1和Si等。己知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素:__________________。

TiCl4(g)+2CO(g) ②四氯化钛的熔、沸点分别为-24℃、136℃,易挥发,在水或淛湿空气中都极易水解,加热时能被O2氧化















