-
CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1;
C(s) +CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g)  CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 10min | 20min | 30min | 40min | 50min | 60min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②下列关于该反应的说法正确的是______________(填选项字母,下同)
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.温度一定时,压强不再随时间变化可以说明反应达到了平衡状态
D.使用高效催化剂,ΔH会增大
③300 ℃时,前10 min内,该反应的平均反应速率为v(H2)=___mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________。
A. 充入CO气体 B. 升高温度
C. 使用优质催化剂 D. 往容器中再充入1 mol CO和2 mol H2
⑤500 ℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向___(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
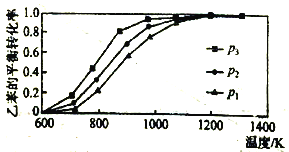
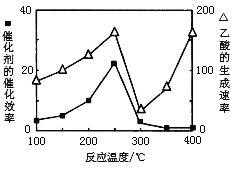
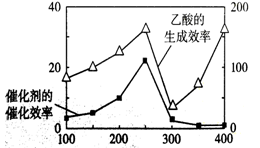
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。当乙酸的生成速率主要取决于温度时,其影响范围是__________________。
-
(13分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
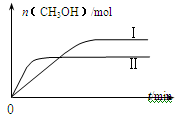
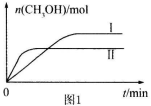
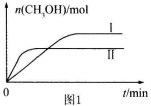
测得CH3OH的物质的量随时间的变化见图。
① 曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
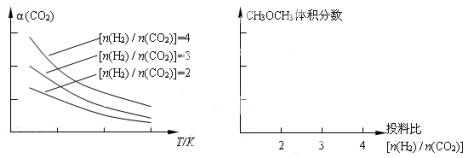
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
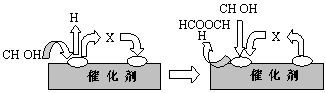
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为: 。
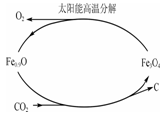
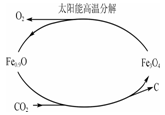
②利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如下图所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。
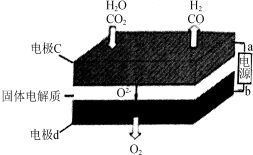
③固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如下图。
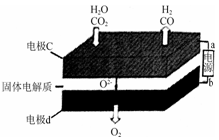
写出电极c上发生的电极反应式: , 。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。
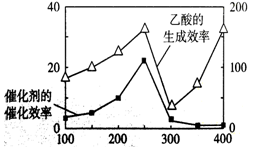
如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系? 。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
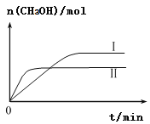
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
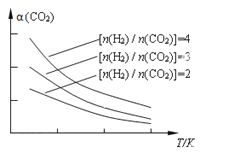
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
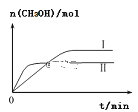
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
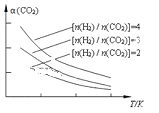
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
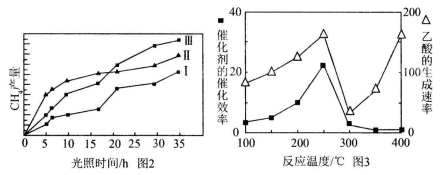
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
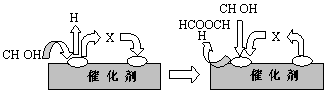
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为: 。
②利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如下图所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。
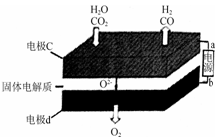
③固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如下图。写出电极c上发生的电极反应式: , 。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见右图。
如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系?
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
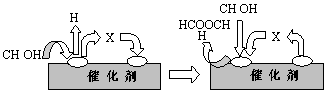
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为: 。

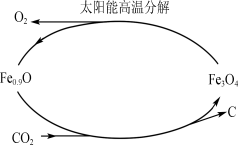
②利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如下图1所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。
③固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图2。写出电极c上发生的电极反应式 。(任写一个)
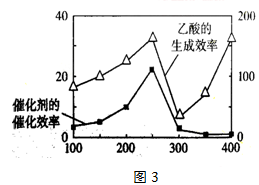
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系 。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2
c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
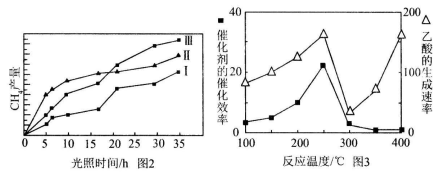
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1;则CO还原Fe2O3(s)的热化学方程式为
A.Fe2O3+ 3CO=2Fe+ 3CO2△H=-28.5 kJ·mol-1
B.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ
C.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H= + 28.5 kJ·mol-1
D.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1
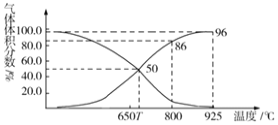
2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示: