-
某小组设计实验探究NaClO溶液与KI溶液的反应,实验记录如表所示:
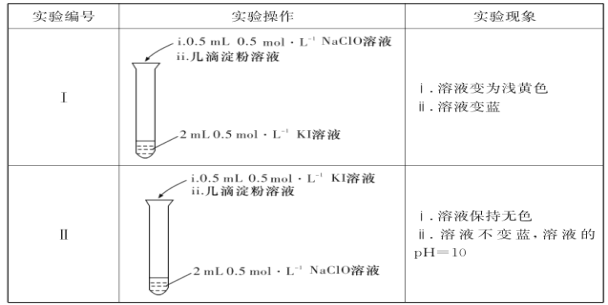
[资料]碘元素形成化合物时主要以I-和IO3-的形式存在。酸性条件下IO3-不能氧化Cl- ,可以氧化I-。ClO-在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L-1 NaClO溶液的pH=11,用离子方程式表示其原因:_____________________。
(2)实验I中溶液变为浅黄色时发生反应的离子方程式是__________________________。
(3)对比实验I和II ,探究实验II反应后“溶液不变蓝”的原因。
①提出假设a:I2在碱性溶液中不能存在。
设计实验Ⅲ证实了假设a成立。实验Ⅲ的操作及现象是_____________________。
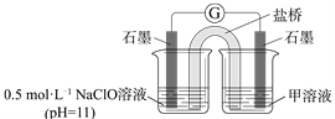
②进一步提出假设b:NaClO可将I2氧化为IO3-。进行实验IV证实了假设b成立,装置如图所示,其中甲溶液是____,实验现象是______。
(4)验证实验II所得溶液中存在IO3-:取适量实验II所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后产生黄绿色有刺激性气味的气体,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验II所得溶液中存在IO3-。
①产生的黄绿色气体是___________(填化学式)。
②有同学认为此实验不能说明实验II所得溶液中存在IO3-理由是_________。欲证明实验II所得溶液中存在IO3-,改进的实验方案是__________。
③实验II中反应的离子方程式是__________。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
(资料):碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:

背影资料:

请你参与以下探究:
(1)实验A反应速度明显比B小,原因是______.
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是______.
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证.
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体.若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl.请你帮他设计验证方案(若有多处方案,只设计两个).
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果.请写出这一平衡关系式(用离子方程式表示):______.
-
某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:

背影资料:

请你参与以下探究:
(1)实验A反应速度明显比B小,原因是______.
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是______.
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证.
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体.若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl.请你帮他设计验证方案(若有多处方案,只设计两个).
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果.请写出这一平衡关系式(用离子方程式表示):______.
-
资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
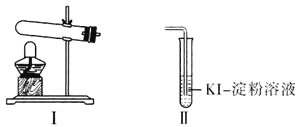
供选试剂: 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 
| 向Ⅰ试管中加入  固体, 固体, Ⅱ试管中加入适量  溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________, 组实验中
组实验中 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
对于实验 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
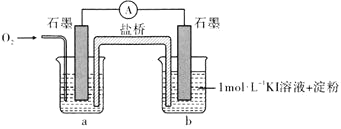
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后________。
后________。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是________
,褪色的原因是________ 用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验 的现象产生的原因可能是________。
的现象产生的原因可能是________。
-
某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| 
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| ② | CH3COOH溶液 | 光照管壁有无色气泡 |
| ③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 |
| ④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
-
亚氯酸钠是重要漂白剂,大庆市某高中化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
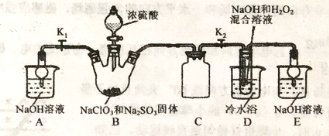
【查阅资料】
I.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成 NaClO3和NaCl。
II.B中发生的主要反应:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
【进行实验】
(1)盛装NaClO3和Na2SO3固体的仪器名称是_____。
(2)装置C的作用是____________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38-60℃热水洗涤;④低于____干燥,得到成品。
右图是某同学的过滤操作示意图,其操作不规范的是________(填标号)。
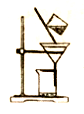
a.将滤纸湿润,使其紧贴漏斗壁
b.滤纸边缘高出漏斗边缘
c.用玻璃棒引流
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
【实验反思】
(1)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______。
(2)实验须使B中NaClO3稍微过量,原因是__________,如NaClO3不足,则装置D中可能产生SO42-,检验装置D中是否含有SO42-的方法是:取少量D中反应后的溶液于试管中,__________,证明溶液中存在SO42-。
(3)测定产品中NaClO2的纯度。测定时进行如下实验:
准确称mg样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。所称取的样品中NaClO2<span lang="EN-US" style="font-size:10.5pt;mso-bidi-font-size:12.0pt;font-family:"Times New Roman","serif";mso-fareast-font-family:"Times New Roman";mso-ansi-language:EN-US;mso-fareast-language:ZH-CN;mso-bidi-language:AR-SA">质量百分含量</span>为_________(用含m、c、V的代数式表示)。

















