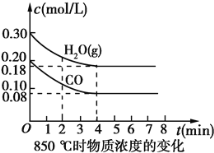
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 2 | 1 | 2 | 3 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(2)在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g)
2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g) CO(g)+ H2(g)平衡常数K1; CO(g)+H2O(g)
CO(g)+ H2(g)平衡常数K1; CO(g)+H2O(g) H2(g)+ CO2(g)平衡常数K2;则K、K1、K2之间的关系是:
H2(g)+ CO2(g)平衡常数K2;则K、K1、K2之间的关系是:
(4)某温度、容积固定容器中,投入一定反应物,对可逆反应C(s)+ CO2(g) 2CO(g)不能判断该反应达到化学平衡状态的是
2CO(g)不能判断该反应达到化学平衡状态的是
A.c(CO2)= c(CO)
B.混合气体相对分子质量不变
C.容器中的压强不变
D.v正(CO)= 2v正(CO2)
E.c(CO)保持不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)  2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.
2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.
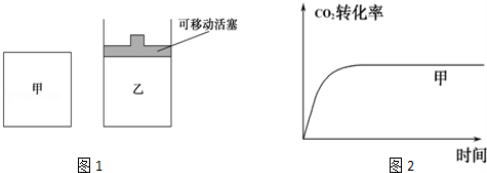
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是:________ 反应(选填:放热、吸热).
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E).
| A | B | C | D | E |
| n(CO2) | 3 | 1 | | 1 | 1 |
| n(H2) | 2 | 1 | | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:________.
(4)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=________.
(5)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K=________.
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是__反应 (填“放热”或“吸热”)
(2)要使上述反应的正反应速率增大且平衡向正反应方向移动,下列措施不可行的有__
A、加入催化剂
B、增大CO的物质的量以提高体系的压强
C、降低温度
D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有_______
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g)
B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g)
D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=__
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K=__,T=__ ℃
-
(6分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是:________ 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E)。
| A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:K=________。
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
⑴上述正向反应是________反应(填“放热”或“吸热”)。
⑵在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
⑶已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是K=________。
⑷若在500℃时进行,设起始时CO和H2O的起始浓度均为0.010mol/L,在该条件下,CO的平衡转化率为:________。
⑸若反应在800℃进行,设起始时CO(g)和H2O(g)共为1mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=________。
-
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).
| A | B | C | D |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问 题。
题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________(填“放热”或“吸热”)反应。
(2)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(填下表中字母编号)。
| n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
(3)已知在一定温度下:
C(s)+CO2(g) 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K2;
CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K;
H2(g)+CO2(g) 平衡常数K;
则K、K1、K2之间的关系是________。
(4)若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO平衡时的转化率为______________。
-
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知 :CO(g)+H2O(g)
:CO(g)+H2O(g) H2(g)+CO2(
H2(g)+CO2( g)的平衡常数随温度
g)的平衡常数随温度 的变化如下表:
的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ____________ (选填字母)。
| A | B | C | D |
| n(CO2)/mol | 3[ | 1 | 0 | 1 |
| n(H2)/mol | 2 | 1 | 0 | 1 |
| n(CO)/mol | 1 | 2 | 3 | 0.5 |
| n(H2O)/mol | 5[ | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是___________。
-
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强________ (填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 _________ (选填字母)。
| A | B | C | D |
| n(CO2)/mol | 3 | 1 | 0 | 1 |
| n(H2)/mol | 2 | 1 | 0 | 1 |
| n(CO)/mol | 1 | 2 | 3 | 0.5 |
| n(H2O)/mol | 5 | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 ________。
-
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/oC | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________________。
(2)上述正向反应是_________________(填“放热”或“吸热”)反应。
(3)某温度下,上述反应达到平衡时,恒容、升高温度,原化学平衡向_________(填“正”或“逆”)反应方向移动,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强_____________(填“增大”“减小”或“不变”)。
(4)有830oC时发生上述反应,按下表中的物质的量投入恒容反应器,其中在向正反应方向进行的有____________(选填A、B、C、D)。
| A | B | C | D |
| n(CO2)/mol | 3 | 1 | 0 | 1 |
| n(H2)/mol | 2 | 1 | 0 | 1 |
| n(CO)/mol | 1 | 2 | 3 | 0.5 |
| n(H2O)/mol | 5 | 2 | 3 | 2 |
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示: