-
工业上合成甲醇的反应为:CO(g) + 2H2(g)  CH3OH(g) ΔH <0。300℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示.
CH3OH(g) ΔH <0。300℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示.
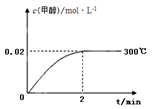
(1)计算300℃时该反应的平衡常数K=_______________.
(2)CO 的平衡转化率为_______________.
(3)下列措施可增大甲醇产率的是____________.
A.压缩容器体积 B.将CO(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(4)可判断可逆反应达到平衡状态的依据是______.
A.v正(CO)= 2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.容器中CO、H2、CH3OH的物质的量之比为1:2:1
E.混合气体压强不再随时间变化而变化
(5)若其它条件不变,使反应在500℃下进行,在上图中作出甲醇的物质的量浓度随时间的变化的示意图.
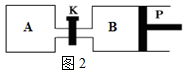
(6)甲醇与水蒸气反应生成氢气的反应方程式:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH>0;反应在图2中进行。其中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为______,A、B两容器中H2O(g)的体积百分含量的大小关系为B______A(填“>”“<”或“=”).
CO2(g)+3H2(g) ΔH>0;反应在图2中进行。其中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为______,A、B两容器中H2O(g)的体积百分含量的大小关系为B______A(填“>”“<”或“=”).
-
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH________0,△S________0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
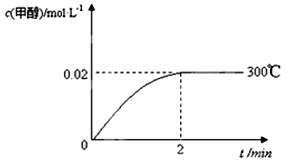
①在0~2min内,以H2表示的平均反应速率为mol·L-1·s-1 ,CO的转化率为________。
②列式计算300℃时该反应的平衡常数K=。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将________。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是________。
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
-
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH________________0,△S________0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为________mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K =________。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将________。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是________
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为 。
。
②平衡时氢气的浓度是 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为
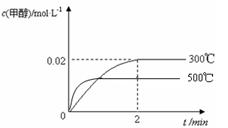
-
(14分)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g) 下表为不同温度下的平衡常数(K)
CH3OH(g) 下表为不同温度下的平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)该反应的平衡常数表达式K= ,ΔH 0(填“>”、“<”或“=”)。
(2)将1 mol的H2 和 1 mol 的 CO充入 1 L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程)。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
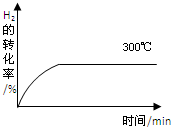
(4)其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图。
-
工业上采用CO和H2合成再生能源甲醇,反应为:2H2(g)+CO(g) CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是______(填“高温”、“低温”或“任意温度”)
②下列说法正确的是______。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
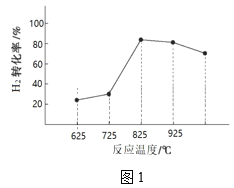
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因______。
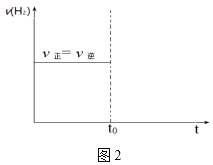
(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=_____k逆。
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图像_____。
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式______。
-
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=________(用含ΔH1、ΔH2表示)
(2)若反应温度升高,CO2的转化率________ (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式________
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:

(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H2)为________;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后H2浓度的变化曲线。
-
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为: CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为:
_______________________________________________;
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、 270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
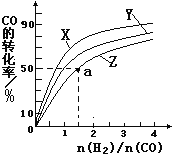
①在上述三种温度中,曲线Z对应的温度是__________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数K=_____________________。
CH3OH(g)的平衡常数K=_____________________。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是_________________________;且该条件所改变的量是_______________。
-
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是_____________。
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数 K= 。
CH3OH(g)的平衡常数 K= 。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是
-
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是

A.CO合成甲醇的反应为吸热反应
B.处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
C.平衡常数K =
D.该反应在T1时的平衡常数比T2时的小
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是_____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1________0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为________。
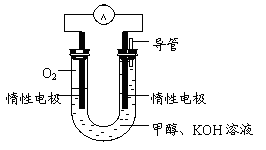
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
CH3OH(g) ΔH <0。300℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示.

CO2(g)+3H2(g) ΔH>0;反应在图2中进行。其中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为______,A、B两容器中H2O(g)的体积百分含量的大小关系为B______A(填“>”“<”或“=”).











