-
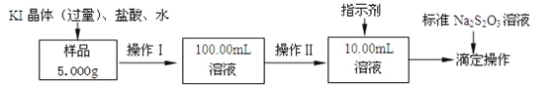
氯化铁是常见的水处理剂。某氯化铁(FeCl3•6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3•6H2O的质量分数,实验按以下步骤进行:
已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.00mL。该样品中FeCl3•6H2O(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作___________________;判断是否恒重的标准是_________________________。
-
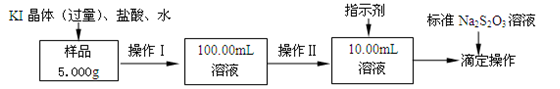
氯化铁是常见的水处理剂。某氯化铁(FeCl3•6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3•6H2O的质量分数,实验按以下步骤进行:
已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.00mL。该样品中FeCl3•6H2O(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作___________________;判断是否恒重的标准是_________________________。
-
氯化铁是常见的水处理剂。某氯化铁 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

已知有关离子方程式为:
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:_____________________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准 溶液18.00mL。该样品中
溶液18.00mL。该样品中 (式量为270.5)的质量分数为_____________。
(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量 杂质除去,可用的试剂是________(选填编号)。
杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作________________________;
判断是否恒重的标准是_______________________________________________________。
-
(10分)有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入10mL 6 moL·L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 ;
(2)加入氯水后,反应的离子方程式为 ;
(3)加入过量氨水生成沉淀的离子方程式为 ;
(4)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是 。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
-
某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量.实验采用以下步骤进行:
1.准确称量m g样品(2~3g);
2.向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
3.量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
4.趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
5.过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重.
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量______.
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是______.
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是______.
(4)加入溴水时发生反应的离子方程式是______.
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2g,则样品中铁元素的质量分数是______.
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净.当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”).①NaCl______②AlCl3______.
-
某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
① 准确称量m g样品(2~3g);
② 向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③ 量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④ 趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤ 过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量。
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是________。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器 是________。
(4)加入溴水时发生反应的离子方程式是________。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是________。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl________ ②Fe2(SO4)3________
-
(13分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量________。
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是________。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是________。
(4)加入溴水时发生反应的离子方程式是________。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是________。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl________ ②Fe2(SO4)3________ ③Mg(NO3)2________
-
某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤ 过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量________。
A.比mg多 B.比mg少 C.恰好为mg
(2)溶解样品时要加入盐酸,原因是________。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器 是________。
(4)加入溴水时发生反应的离子方程式是________。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是________。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl________ ②Fe2(SO4)3________
-
有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入l0mL 6 mol · L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
请回答下列问题:
(1)溶解样品时,要加入盐酸,原因是_____________________________。
(2)加入氯水后,反应的离子方程式为_____________________________。
(3)加入过量氨水生成沉淀的离子方程式为_________________________。
(4)若不用氯水,可用下列试剂中的_________代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是________。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为:_______(请把结果约到最简)。
-
(16分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)
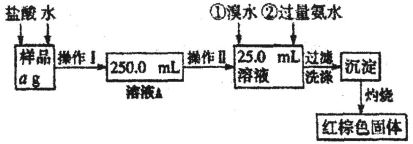
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色
C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到Fe2O3固体



