-
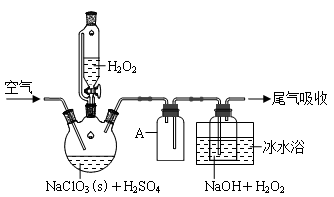
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。请回答:
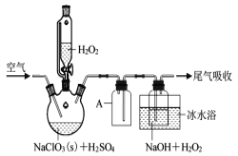
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
(1)仪器A的作用是______________________;
冰水浴冷却的目的是___________________(写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________。
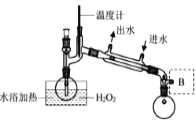
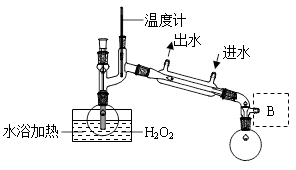
(3)Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①____________________________(用离子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。(4)H2O2浓度对反应速率有影响。通过图所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是_________,馏出物是_________。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
-
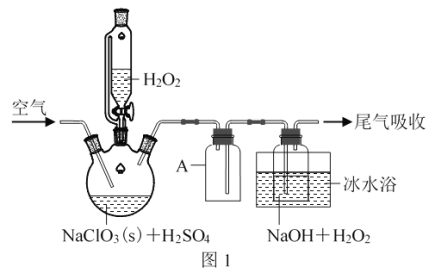
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(1)仪器A的作用是________;冰水浴冷却的目的是________(写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因________。
(3)Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①________(用离子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
-
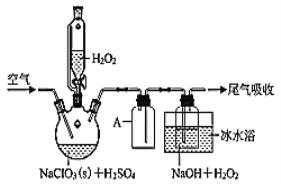
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。请回答:
已知:①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
②ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
(1)NaClO2中氯元素的化合价是__。
(2)仪器A的作用是__。
(3)写出制备NaClO2固体的化学方程式:__。冰水浴冷却的目的是__(写两种)。
(4)空气流速过快或过慢,均降低NaClO2产率,试解释其原因__。
(5)Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①__(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(6)为了测定NaClO2粗品的纯度,取上述粗产品10.0g溶于水配成1L溶液,取出10mL,溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),该反应过程中氧化剂与还原剂的物质的量之比为__,加入2~3滴淀粉溶液,用0.20mol•L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL,试计算NaClO2粗品的纯度__。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)
-
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃

图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
-
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO2+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
⑴仪器A的作用是_____;冰水浴冷却的目的是_____(写出两种)。
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因______。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_____(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是______,馏出物是_______。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
-
ClO2是一种优良的消毒剂,其溶解度约是Cl2的5倍,但温度过高、浓度过大时均易发生分解,因此常将其制成固体,以便运输和贮存。制备KClO2固体的实验裝置如图所示,其中A装置制备ClO2,B装置制备KClO2。请回答下列问题:

(1)仪器a的名称是________。
(2)滴液漏斗与普通分液漏斗相比,其优点是_________。
(3)加入的硫酸需要用冰盐水冷却的原因是_________。
(4)实验过程中通入空气的目的是________,空气流速过快或过慢,均降低KClO2产率,试解释其原因________ 。
(5)用图示装置制备的KClO2中含有较多杂质,其原因是________。
(6)A中制备ClO2的化学方程式为_________ 。
(7)有人认为用图示装置吸收ClO2易引起倒吸,但经过多次实验均未发现有倒吸现象,其原因是________。
-
ClO2是一种优良的消毒剂,常将其制成NaClO2 固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:① 2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃

请回答:
(1)仪器B的作用是__________________,仪器A的作用是_________________,冰水浴冷却的目的是____________________(写两种)。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因________________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①_____________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+
(5) NaClO2纯度测定:①准确称取所得 NaClO2样品10.0g 于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3 次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中 NaClO2的质量分数为____________________。(M(NaClO2)=90.5g/mol)
-
ClO2是一种优良的消毒剂,常将其制成NaClO2 固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:① 2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
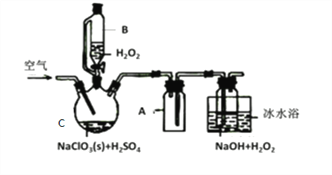
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得 NaClO2样品10.0g 于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3 次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中 NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
-
ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
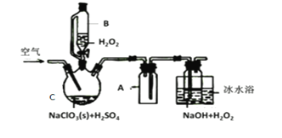
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
-
ClO2是一种优良的消毒剂,其溶解度约是Cl2的5倍,但温度过高浓度过大时均易发生分解,因此常将其制成KClO2固体,以便运输和贮存。制备KClO2固体的实验装置如图所示,其中A装置制备ClO2,B装置制备KClO2。请回答下列问题:
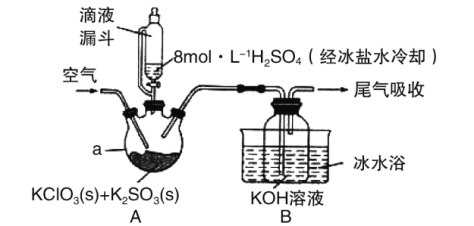
(1)A中制备ClO2的化学方程式为__。
(2)与分液漏斗相比,本实验使用滴液漏斗,其优点是__。加入H2SO4需用冰盐水冷却,是为了防止液体飞溅和__。
(3)实验过程中通入空气的目的是__,空气流速过快,会降低KClO2产率,试解释其原因__。
(4)ClO2通入KOH溶液生成KClO2的同时还有可能生成的物质__。
a.KCl b.KClO c.KClO3 d.KClO4
(5)KClO2变质分解为KClO3和KCl,取等质量的变质前后的KClO2试样配成溶液,分别与足量的FeSO4溶液反应消耗Fe2+的物质的量__(填“相同”、“不相同”“无法确定”)。













