-
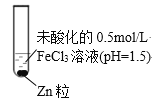
某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 
| 实验 | 条件 | 现象 |
| ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
| ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
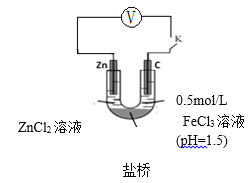
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
| 实验ⅲ | 实验ⅳ |
| 
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
| 实验 | 条件 | 现象 |
| ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
| ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
-
某小组同学利用下列实验探究金属铝与不同铜盐溶液的反应:
| 实验 | 实验方案 | 现象 |
| 1 | 向5mLlmol/L CuSO4 溶液中加入用砂纸打磨过的铝片 | 铝片表面无明显现象,20min 后铝片表面有极少气泡,且有很少量红色物质生成 |
| 2 | 向5mLlmol/LCuCl2溶液中加入用砂纸打磨过的铝片 | 铝片表面有气泡产生,同时有红色物质析出,1min后反应进一步加快,放出大量的热,有少量黑色固体生成。一段时间后烧杯底部出现白色沉淀 |
(1)打磨铝片的目的是_____________________________。
(2)实验中出现的红色物质是_______________________________。
(3)实验2 中“1min 后反应进一步加快”的原因是________________________________。
(4)经检验实验1、2 中产生的无色气体是H2,黑色固体为CuO,试用离子方程式解释H2 产生的原因__________________________,用文字简述黑色固体产生的原因____________________________。
(5)依据上述实验1、2现象推测并判断,用砂纸打磨后的铝片分别与H+浓度均为0.2mol•L-1的盐酸和硫酸反应,反应速率:前者比后者____________(填“快”或“慢”)
(6)经证明实验2 中白色沉淀的化学成分为CuCl。某同学猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有________性。依据猜测他进行了如下实验:取Cu粉与适量1mol/LCuCl2溶液混合,一段时间后观察无白色沉淀产生。该同学再次分析Al 与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,他的改进方法为__________________。
-
资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
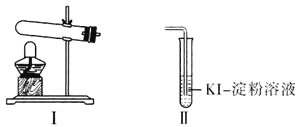
供选试剂: 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 
| 向Ⅰ试管中加入  固体, 固体, Ⅱ试管中加入适量  溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________, 组实验中
组实验中 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
对于实验 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
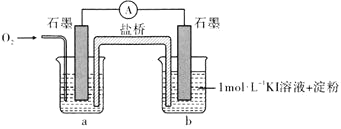
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后________。
后________。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是________
,褪色的原因是________ 用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验 的现象产生的原因可能是________。
的现象产生的原因可能是________。
-
资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
| 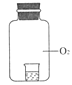
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
| ②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 |
| ③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 |
| ④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________。
(3)实验④比②溶液颜色浅的原因是_________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
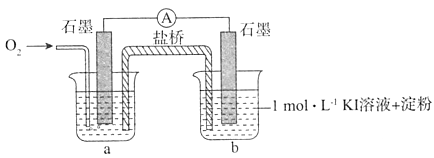
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,________。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)_____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是_______;实验⑥的现象产生的原因可能是_______。
-
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
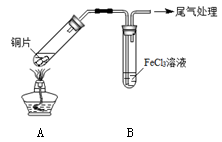
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
-
化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
| 实验装置 | 实验现象 |
| 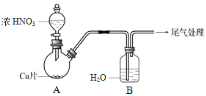
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
| 序号 | 实验操作 | 实验现象 |
| III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
| IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。
-
某实验小组对KSCN的性质进行探究,设计如下实验:
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
|  
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
| Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。
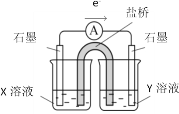
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN- [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN- [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
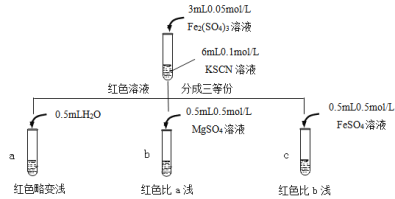
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
-
某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
-
某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验Ⅰ:
试剂:酸化的0.5mol·L-1FeSO4溶液(pH=0.2),5%H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是__。
(2)产生气泡的原因是__。
(3)某同学认为,根据“溶液变红”不能说明FeSO4与H2O2发生了反应,又补充了实验II证实了该反应发生。实验II的方案和现象是__。
实验III:
试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5%H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL5%H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(4)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。
①检验棕黄色沉淀中SO42-的方法是______。
②结合方程式解释实验III中溶液pH降低的原因______。
实验IV:
用FeCl2溶液替代FeSO4溶液,其余操作与实验III相同,除了产生与III相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(5)将反应得到的混合物过滤,得到黄色沉淀。将黄色沉淀洗净,加稀盐酸,沉淀不溶解。经检验沉淀中n(Fe):n(Cl)=1:1,写出生成黄色沉淀的化学方程式___。
(6)由以上实验可知,亚铁盐与H2O2反应的现象与______(至少写两点)有关。
-
某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验I】试剂:酸化的0.5mol·L-1 FeSO4溶液(pH =0.2),5%H2O2溶液(pH=5)。
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH = 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________________________。
(2)产生气泡的原因是______________________。
【实验Ⅱ】试剂:未酸化的0.5mol·L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL5%H2O2溶液于试管中, 加入5滴上述FeSO4溶液, | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH =1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4 mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是_______________。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.H2O2溶液氧化Fe2+消耗H+
ii. Fe2+氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是____________________。
②实验验证假设ⅱ: 取__________溶液,加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是_________________。
【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是___________________。
(7)由实验I、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与______________(至少写两点)有关。









