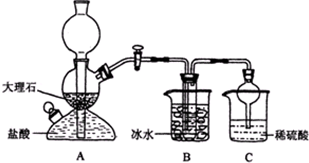
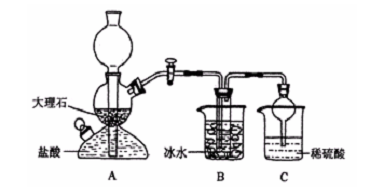
-
工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因___________________________;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
| 分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
| 甲组 | _______________ | 失败 | ____________ |
| 乙组 | ____________ | 成功 | |
| 丙组 | ______________ | 成功 | |
-
工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。
NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:a.石灰石 b.生石灰 c.6mol/L盐酸 d.稀硫酸
e.浓氨水 f.饱和氯化钠溶液。
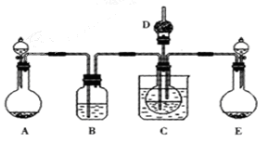
①A中制备气体时,所需药品是(选填字母代 号) ;
①B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④E装置向C中通气的导管不能插入液面下的原因是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
-
(15分)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。 NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:A.石灰石 B.生石灰 C.6mol/L盐酸 D.稀硫酸 E.浓氨水 F.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④E装置向C中通气的导管不能插入液面下的原因是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
-
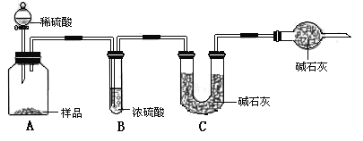
(10分)在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为: 。
C装置中稀硫酸的作用为: 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
-
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
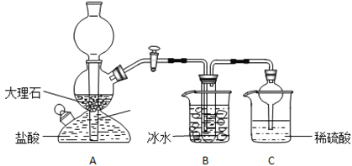
(1)A装置中所发生反应的离子方程式为:_________________。C装置中稀硫酸的作用为:________________。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为________________。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 ______装置____之间(填写字母)连接一个盛有_________ 的洗气装置,其作用是___________。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。请通过简单实验判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:______________。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为__________。
-
工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)
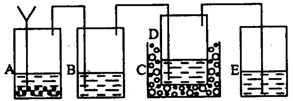
(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?
-
某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl
向饱和食盐水中通入足量氨气至饱和,然后通入二氧化碳,析出溶解度较小的碳酸氢钠.
(二)实验装置:所需实验药品和装置如图所示:

(三)实验步骤
(1)搭好装置,然后应该进行的操作是__________。
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入).仪器A的名称是__________,选择用稀硫酸而不用稀盐酸的好处是__________。
(3)先打开__________(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,烧瓶中产生气体的原理是__________,大约20分钟左右时,观察到饱和食盐水上方有__________大量的白雾
现象时,再打开__________(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.
(四)纯碱制备:
(4)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是__________(不加任何其它试剂,装置任选),反应的化学方程式为__________;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为__________g。
-
某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠。(1)写出相关离子方程式 。
(二)实验装置:所需实验药品和装置如下图所示:
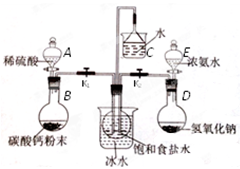
(三)实验步骤:
(2)组装好装置,然后应该进行的操作是 。
(3)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中 加入足量稀硫酸于(可分多次加入)。仪器A的名称是 ,选择用稀硫酸而不用稀盐酸的好处是 。
加入足量稀硫酸于(可分多次加入)。仪器A的名称是 ,选择用稀硫酸而不用稀盐酸的好处是 。
(4)先打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶。大约20分钟左右时,观察到饱和食盐水上方有 现象时,再打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。
(四)纯碱制备:
(5)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g。
-
(15分)已知NaHCO3低温时溶解度小。德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
①NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
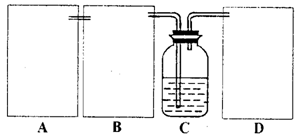
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下_________装置(填序号)。简述该装置能随关随停的理由________________。
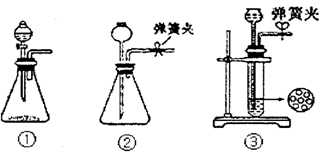
(2)为使实验能够进行,在B、D方框内补上所需装置:_________________(将装置图画在答题卡上),并指明所用试剂:_________________。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少。老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是___________________。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______________。
-
某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置的名称是:________.C装置中稀硫酸的作用为:________,使用球形干燥管的目的是:________.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为________.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在________装置之间(填写字母)连接一个盛有________的洗气装置,其作用是________.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为________.