-
五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。
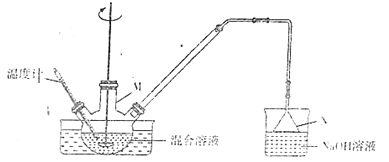
制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
-
五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘加热装置及夹持装置省略。
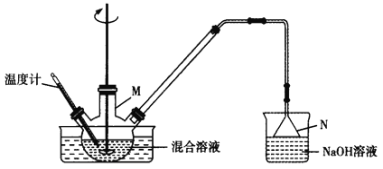
制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃。搅拌反应lh,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾[KH(IO3)2]晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为__。
(2)仪器M的名称是__。反扣的漏斗N除了可以防止倒吸,还有一个作用是__。
(3)步骤1中除了生成碘酸氢钾外,同时还生成氯化钾和氯气,若n(KCl):n(Cl2)=5:3,写出该反应的化学方程式:___。
(4)步骤2中的主要反应为IO3-+5I-+6H+=3I2+3H2O,称取0.700g碘酸钾产品假设杂质不参与反应,将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1molL-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为18.00mL。已知:I2+2Na2S2O3=2NaI+Na2S4O6
如何判断该滴定终点___。
该碘酸钾产品中碘酸钾的质量分数是___保留三位有效数字。
若装Na2S2O3标准溶液的滴定管尖嘴部分滴定前无气泡,滴定后又有气泡,则所测得产品的质量分数___填“偏高”或“偏低”。
-
下列关于乙醇的叙述中,正确的是( )
A.可作燃料,但对空气污染
B.易溶于水,不溶于苯和四氯化碳
C.与乙醚互为同分异构体
D.食用酒精可用粮食发酵制取
-
(1 5分)无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾。氯化铝还易溶于乙醇、氯仿和四氯化碳。
实验室可用反应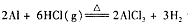 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
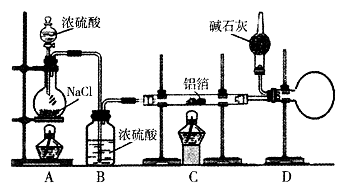
(1)A烧瓶中发生反应的化学方程式:
(2)以下三步操作的先后顺序为 (填序号)。
①点燃A处酒精灯
②点燃C处酒精灯
③滴加A处浓硫酸
(3)D中干燥管内碱石灰的作用是 。
(4)下列有关AICl3的说法合理的是 (填序号)。
①AlCl3水溶液能导电
②熔融态AlCl3能导电
③镁条能置换出AlCl3溶液中的Al
(5)实验室也可通过反应 制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
(6)指出该实验装置可能存在的一种安全隐患: 。
-
氯化亚铜(CuCl)可用作催化剂、杀菌剂、媒染剂、脱色剂。CuCl是一种白色粉末,微溶于水、不溶于乙醇,在潮湿的空气中易被氧化。实验室采用如图装置和下列步骤制备氯化亚铜。
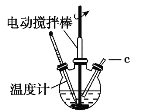
步骤1:在三颈烧瓶中加入20%盐酸、食盐、铜屑,加热至60~70℃,开动搅拌器,同时从c口缓慢通入氧气,制得Na[CuCl2]溶液。
步骤2:反应完全后,冷却,过滤,滤液用适量的水稀释,析出CuCl。
步骤3:过滤,分别用盐酸、乙醇洗涤滤出的固体。
步骤4:在真空干燥器中60~70 ℃干燥2h,冷却后得到产品。
回答下列问题:
(1)质量分数为20%的盐酸密度为1.1g/cm3,物质的量浓度为___________;配制20%盐酸需要的玻璃仪器有:__________、烧杯、玻璃棒、胶头滴管。
(2)步骤1中制得Na[CuCl2]的化学方程式为________________________________。
(3)根据“步骤2中用水稀释滤液能得到CuCl”推测,滤液中存在的平衡是____________。
(4)析出的CuCl晶体不用水而用盐酸、乙醇分别洗涤的目的是__________________。
(5)测定产品中氯化亚铜的质量分数,实验过程如下:
准确称取制备的氯化亚铜产品0.25 g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.10 mol/L的硫酸铈[Ce(SO4)2]标准溶液滴定到终点,消耗硫酸铈溶液24.50 mL,反应中Ce4+被还原为Ce3+。(已知:CuCl+FeCl3=CuCl2+FeCl2)
①硫酸铈标准溶液应盛放在________(填“酸”或“碱”)式滴定管中。
②产品中氯化亚铜的质量分数为________。
-
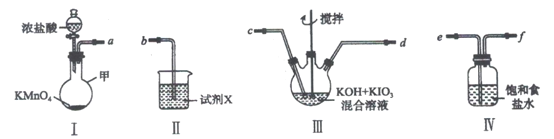
高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
-
高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:
(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
-
下列说法正确的是
①非金属氧化物一定是酸性氧化物
②依据丁达尔现象可将分散系分为溶液、胶体与浊液
③利用金属钠可区分乙醇和乙醚
④碱性氧化物一定是金属氧化物
⑤某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,说明该钾盐是K2CO3
⑥欲配制1L1.00mol/L的KCl溶液,可将74.5gKCl溶于1L水中
⑦质子数、中子数和电子数都相同的粒子一定是同一种粒子。
A.全部 B.①②③④⑦ C.①②④ D.③④
-
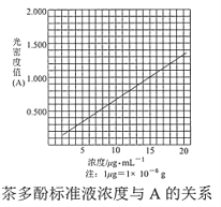
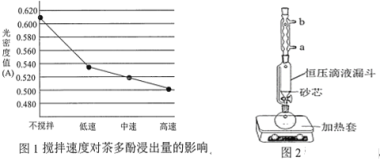
茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
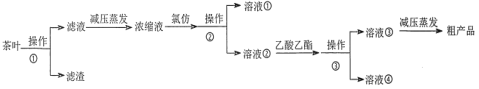
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
-
保险粉(Na2S2O4)可用作食品保鲜剂、纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。锌粉法制备Na2S2O4的工艺流程如图所示:
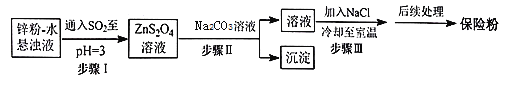
回答下列问题:
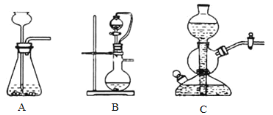
(1)实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
(2)工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_________;步骤Ⅰ中发生反应的化学方程式为__________。
(3)步骤Ⅱ中需选用的玻璃仪器除了烧杯、玻璃棒之外,还有__________(填名称)。
(4)在步骤III中加入NaCl的作用是_______,得到的Na2S2O4固体要用乙醇洗涤,其优点是_________。
(5)铁氰化钾可用于分析检测保险粉。铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将 氧化为
氧化为 ,[Fe(CN)6]3−还原为[Fe(CN)6]4−,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L−1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
,[Fe(CN)6]3−还原为[Fe(CN)6]4−,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L−1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。


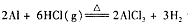 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置:







