-
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出E基态原子的电子排布式________;E在周期表中的位置是________ ,其基态原子有________种能量不同的电子。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,

该同学所画的电子排布图违背了________。
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ________,X是一种超硬物质,耐磨损、抗腐蚀能力强,推测X的晶体类型为________ 。
(4)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 ________。
(5) 已知D晶体的粒子堆积方式为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则D晶体的密度为________g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则在D晶胞中用r表示出这种堆积模型的空间利用率为________。(列式表示,不需化简)
-
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比
B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为序40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2∶1。请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺为下列的________(填序号)。
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)CB3分子的空间构型是________,其固体时的晶体类型为______________。
(3)写出D原子的核外电子排布式:________________________,C的氢化物比D的氢化物在水中的溶解度大得多的原因是__________________________________________。
(4)B元素和D元素的电负性大小关系为____________。
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有______个,这些B-围成的空间几何构型为____________。
-
有主族元素A,B,C,D四种元素,原子序数依次递增,A元素原子2p轨道上有2个未成对电子。B原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D原子得一个电子填入3p轨道后,3p轨道为全充满。
请回答下列问题:
(1)AC2分子中含有______个π键,属于________分子(填“极性”或“非极性”)。
(2)B的氢化物的立体构型为____________,B原子的原子轨道采用________杂化。
(3)写出A的常见氧化物与B的氧化物中互为等电子体的一组物质:_______________________________。
(4)C元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式表示:_________________________________。
-
(11分)A、 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1, X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R基态原子的核外电子排布式是______________________。W在周期表中的位置是
(2)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.极性键 C.配位键 D.金属键
(3)A原子的第一电离能 (填“大于”、“小于”或“等于”)X原子的第一电离能;A元素的氢化物是一种易液化的气体,该气体易液化的原因是 。
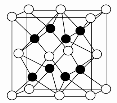
(4)X与Y形成的化合物Y2X2的电子式 ,其晶体类型 。X与Y形成的化合物的晶胞如图所示,则该化合物的化学式为________(请用推断出的元素符号表示)。
(5)Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为___________ 。
-
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
(1)CB3分子中心原子的杂化类型是_________ ;
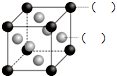
(2)如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内写出对应的元素符号.
(3)B、D元素最高价氧化物对应的水化物的酸性强弱:_________(填化学式).
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_________;
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为_________;
(6)24g E的单质在33.6L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量.则1mol E与O2反应生成E的低价氧化物时的热化学方程式为_________(已知:E的燃烧热为y kJ/mol)
-
【化学——选修3物质结构与性质】已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增. R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
(1)写出Z的基态原子的外围电子排布式_____。
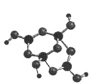
( 2)R的某种钠盐晶体,其阴离子Am- (含R、W、氢三种元素)的球棍模型如上图所示: 在Am- 中,R原子轨道杂化类型有_____ ;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原 子 所构成的立体几何构型为_____。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]S04,下列说法正确的是_____
A. [Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B. 在[Z(NH3)4 ]2+中Z2+给出孤对电子,NH3提供空轨道
C. [Z(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D. SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6- 构成的离子晶体,其晶体结构与CsCl相似。若晶胞边长为a pm,则晶胞的密度为_____g•cm-3.
-
(14分)A、B、C、D四种元素处于同一周期。在同族元素中,A的气态氢化物沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻。(1)C原子的价电子排布式为___________________
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)_____________。
(3)B的单质分子中存在①________个 键;D的最简单气态氢化物分子中的中心原子轨道采用②________杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
键;D的最简单气态氢化物分子中的中心原子轨道采用②________杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
④ ________(填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因____________________________________。
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等,则
A.原子半径:丙>丁>乙
B.甲的气态氢化物的水溶液呈酸性
C.丙与乙形成的化合物具有两性
D.同周期元素中丁的最高价氧化物对应的水化物的酸性最强
-
A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

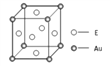
(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。
-
(14分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度是同族元素所形成的氢化物中最大的;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:

⑴A单质、B单质、化合物R的熔点大小顺序为下列的 ________(填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为________;
⑶写出D原子的核外价电子排布式_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因________
________;
⑷右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体
中阴、阳离子数之比为________,FeD2物质中具有的化
学键类型为________。



