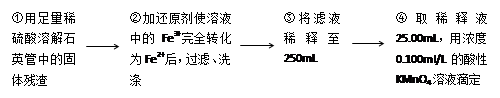-
(12分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
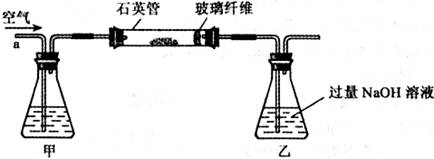
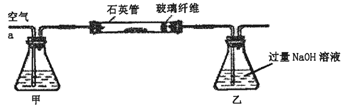
将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
写出石英管中发生反应的化学方程式为:
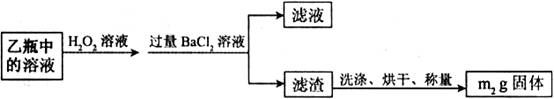
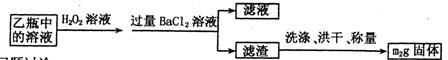
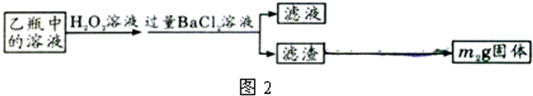
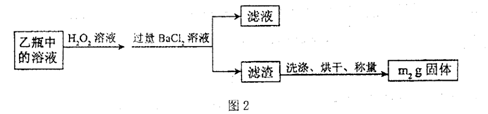
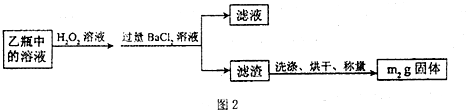
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式有________________________________、________________________________。
(2)Ⅱ中,所加H2O2溶液需足量的理由是_______________________________。
(3)该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]:设计以下实验方案测定铁元素的含量
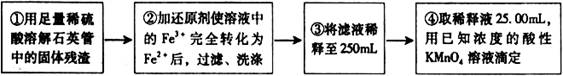
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?________ 。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________________。
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.
【实验一】:测定硫元素的含量
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体.写出石英管中发生反应的化学方程式为:______ 2Fe2O3+8SO2
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.
[实验一]测定黄铁矿中硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)Ⅰ中,石英管中发生的反应方程式为______ 2Fe2O3+8SO2
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
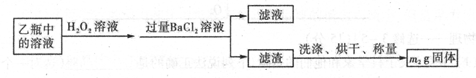
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
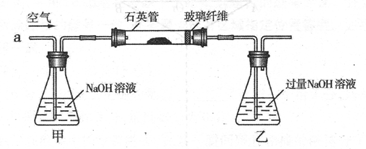
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
-
(15分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: 。
。
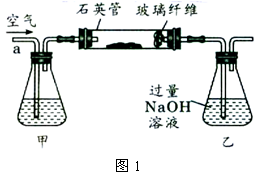
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。

[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示。

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有:________、________。
(2)Ⅱ中的滤渣在称量前还应进行的操作是________。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
④中取稀释液25.00ml需用的仪器是________。
(5)该黄铁矿中硫元素的质量分数为。
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成 分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究.
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2→2 Fe2O3+8SO2(高温)
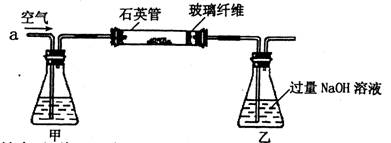
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)1中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有
________、________。
(2)Ⅱ中,所加H2O2溶液需足量的理由是。
(3)该黄铁矿石中硫元素的质量分数为________。
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
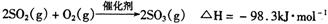 在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的________。
②工业生产中常用氨一酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用化学方程式表示其反应原理。(只写出2个方程式即可)
________
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

 [实验二]测定铁元素的含量。
[实验二]测定铁元素的含量。
III、测定铁元素含量的实验步骤如图所示。
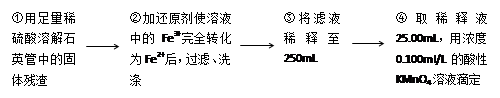
问题讨论:
(1)I中,甲瓶内所盛试剂是____溶液。乙瓶内发生反应的离子方程式为____。
(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为_____________________。
(3)该黄铁矿中硫元素的质量分数为_______________________。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有____________________________________________。
(5)III的步骤④中,表示滴定已达终点的现象是________
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+)。根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为。
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2.
2Fe2O3+8SO2.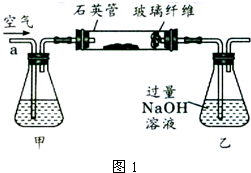
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理.
[实验二]测定铁元素的含量.
Ⅲ、测定铁元素含量的实验步骤如图3所示.

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是______溶液.乙瓶内发生反应的离子方程式有:______、______.
(2)Ⅱ中的滤渣在称量前还应进行的操作是______.
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是______.
(4)④中取稀释液25.00ml需用的仪器是______.Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______(画出其简易装置图).
(5)该黄铁矿中硫元素的质量分数为______.
-
(16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m,g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。

II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是________。
(2)I中,甲瓶内所盛试剂是________溶液;乙瓶内发生反应的离子方程式有________;I中玻璃纤维的作用是________。
(3)II中,所加H2O2溶液需足量的理由是。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有________;
(5)该黄铁矿中硫元素的质量分数________(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数________(用I、II中有关实验数据表达)
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)


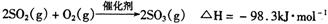 在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。