-
(11分)海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如下图:
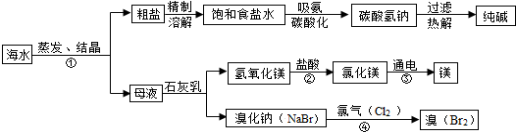
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是 。
(3)由上述流程图看出碳酸氢钠的热稳定性 (填“大于、小于或等于)纯碱的热稳定性。
(4)步骤②发生的反应属于 反应(填一种基本反应类型)。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),
反应后溴元素的化合价比反应前 (填“升高”或“降低”或“不变”)。
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 | 第 1 次 | 第 2次 | 第 3次 |
| 所取固体样品的质量/g | 13 | 10 | 10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g | 100 | 100 | 125 |
| 反应后生成沉淀的质量/g | 8 | 8 | 8 |
完成下列计算:
①固体样品中氯化钠的质量分数是 ;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
-
(10分)海水是巨大的资源宝库。如下图所示利用海水为原料可获得许多化工产品:
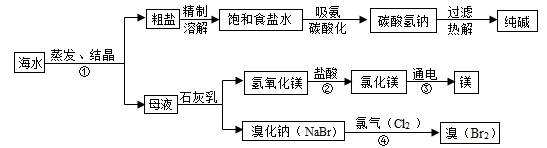
(1)要鉴别海水是硬水还是软水,可选用的试剂是 ;
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 ;
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 ;
(4)步骤②发生反应的化学方程式是 ,其基本反应类型为 (选填“化合”、“分解”、“置换”或“复分解”)反应;
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 。
-
海水是巨大的资源宝库。如下图所示,实验室以海水为原料获得许多化工产品:

(1)完成步骤①,过滤之前的操作是__________________(填操作名称);
(2)整个实验中可以循环使用的物质是_____(填名称);
(3)步骤②发生的是置换反应,试写出该反应的化学方程式:_____________________。
(4)粗盐中除了NaCl之外,还含有MgCl2和CaCl2等杂质,要最终得到纯净的NaCl,应该选用的一组药品是_____________________________(填序号)。
A.过量KOH溶液、过量K2CO3溶液、适量稀盐酸
B.过量Na2CO3溶液、过量NaNO3溶液、过量稀硫酸
C.过量NaOH溶液、过量Na2CO3溶液、过量稀盐酸
D.过量NaOH溶液、过量Na2CO3溶液、适量稀硫酸
-
海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
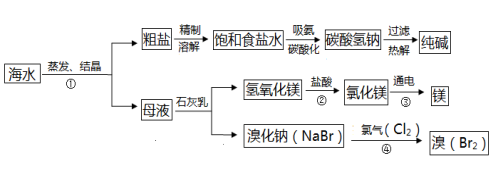
(1)要鉴别海水是硬水还是软水,可选用的试剂是 (18) 。
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 (19) 。
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 (20) 。
(4)步骤②发生反应的化学方程式是 (21) ,③发生的化学方程式 (22) 。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 (23) ;
-
海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
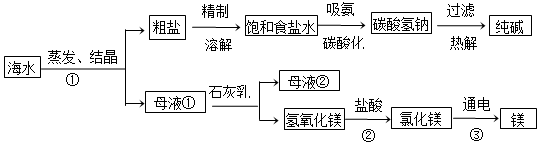
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 。
(2)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 。
(3)步骤②(氢氧化镁 氯化镁)发生反应的化学方程式是___________________。
氯化镁)发生反应的化学方程式是___________________。
(4)步骤③(氯化镁 镁)发生反应的化学方程式是___________________。
镁)发生反应的化学方程式是___________________。
-
海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
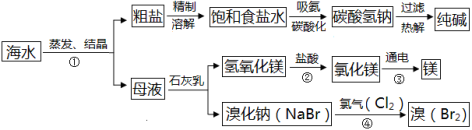
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 。
(2)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 。
(3)步骤②发生反应的化学方程式是 ,其基本反应类型是 。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能
有 (任答一点)。
(4)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 。
-
(9分)海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
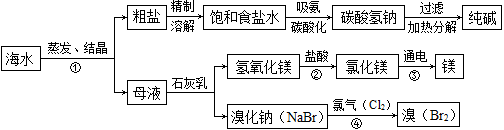
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 。
(2)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 。
(3)步骤②发生反应的化学方程式是 ,其基本反应类型为 。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(4)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 ;此反应能够发生是因为 。
-
海水是巨大的资源宝库.如图所示利用海水为原料科获得许多化工产品:

(1)要鉴别海水是硬水还是软水,可选用的试剂是______.
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是______.
(3)制纯碱过程中,其中过滤操作所需要的仪器有烧杯、漏斗和______.
(4)步骤②发生反应的化学方程式是______,其基本反应类型为______,用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具备的优良性能有______(任答一点)
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式______,此反应能够发生是因为______.
-
海水是巨大的资源宝库。如图所示,利用海水为原料可获得许多化工产品:
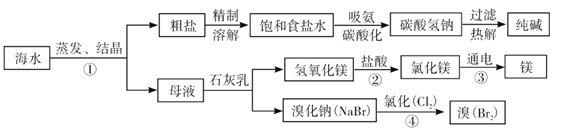
(1)要鉴别海水是硬水还是软水,可选用的试剂是_________。
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是_________________________。
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和________。
(4)步骤④发生反应的化学方程式是_______________________________,其基本反应类型为__________。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有__________________________(任答一点)。
-
海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品。
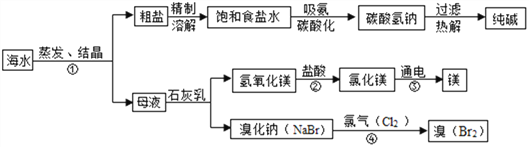
(1)要鉴别海水是硬水还是软水,可选用_________________;
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是________________________;
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和_____________;
(4)步骤②发生反应的化学方程式是________________,其基本反应类型为________;
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式________________。









