-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
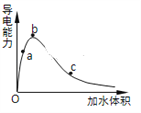
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶 液
液 中结合H+的能力由大到小的顺序为_____________。
中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c (OH-)
(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
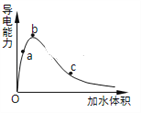
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)以上三种电解质由强至弱顺序为________________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为_____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>、<或=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为___________________________________________________。
(4)已知NaHSO3溶液显酸性,其原因是____________________(离子方程式配适当文字叙述)。
(5)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
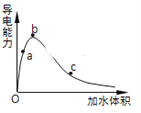
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7
K2=5.6×10-11 | K1=1.5×10-2
K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7
K2=5.6×10-11 | K1=1.5×10-2
K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7
K2=5.6×10-11 | K1=1.5×10-2
K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
-
25℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7
K2=5.6×10-11 | K1=1.5×10-2
K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
液
中结合H+的能力由大到小的顺序为_____________。


