-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
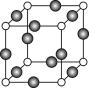
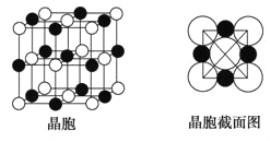
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为______.
(2)关于B2A2的下列说法中正确的是______.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是______.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因______.
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有______ 键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为______,N的结构式为______.
(6)E的氢化物的价层电子对互斥理论模型为______,E 原 子的杂化方式为______杂化.
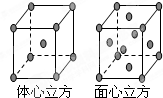
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______,F原子配位数之比为______.
-
已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.

(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
-
已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:__________________,E元素位于元素周期表__________________。
(2)A、B、C三种元素的第一电离能最大的是_________(用元素符号表示)。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________________________ (写化学式)。
(3)D可形成化合物[D(H2O)6](NO3)3 。①[D(H2O)6](NO3)3中配位体的VSEPR模型名称是__________________。该化合物中阴离子的中心原子的轨道杂化类型为_________。
②1 个 [D(H2O)6]3+ 中含有的σ键数目为_________个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子,另一种化合物的电子式为_________。
(5)E+离子能与SCN-离子形成ESCN沉淀。SCN-离子对应的酸有硫氰酸(H―S―C≡N)和异硫氰酸(H―N=C=S),这两种酸沸点更高的是______________(填名称),原因是________________________。
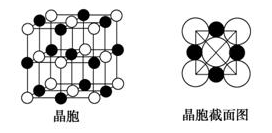
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个A+最近的A+有_______个,距离一个A+最近的C-围成的图形是______________(写名称)。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的半径为_________cm(用含NA与ρ的式子表达)。
-
已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:______,E元素位于元素周期表______。
(2)A、B、C三种元素的第一电离能最大的是______ 用元素符号表示
用元素符号表示 。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______
。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______  写化学式
写化学式 。
。
(3)D可形成化合物 。
。
 中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
 个
个 中含有的
中含有的 键数目为______个。
键数目为______个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_____________ 填化学式
填化学式 为非极性分子,另一种化合物的电子式为_____________。
为非极性分子,另一种化合物的电子式为_____________。
(5) 离子能与
离子能与 离子形成ESCN沉淀。
离子形成ESCN沉淀。 离子对应的酸有硫氰酸
离子对应的酸有硫氰酸 和异硫氰酸
和异硫氰酸 ,这两种酸沸点更高的是______(填名称),原因是__________。
,这两种酸沸点更高的是______(填名称),原因是__________。
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个 最近的
最近的 有______个,距离一个
有______个,距离一个 最近的
最近的 围成的图形是_____________
围成的图形是_____________ 写名称
写名称 。若晶体密度为
。若晶体密度为
 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则
表示,则 的半径为____________________
的半径为____________________ 用含
用含 与
与 的式子表达
的式子表达 。
。
-
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
-
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
-
(8分)已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X________、Y________、Z________、W________
(2)由以上元素中的两种元素组成的能溶于水产生气体且水溶液显碱性的化合物的电子式为。
(3)由X、Y、Z所形成的离子化合物是,它与W的最高氧化物的水化物的稀溶液反应的离子方程式是 。
-
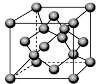
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他3种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子。请回答:
(1)A与C形成的共价化合物的分子式是 ,中心原子杂化类型是__ ,分子的立体结构是 ,是 分子(填“极性”或“非极性”)
(2)B与C比较,电负性较小的是 (填元素符号);B与C形成的化合物晶体类型是 。
(3)D位于元素周期表中第 族,D2+的结构示意图是 ,它的+3价离子的电子排布式为 。
(4)A与B形成的化合物分子极易溶于水,其原因 是 。
(5)由C原子构成的晶体中微粒间作用力是 ,右图是由C单质构成的晶体的一个晶胞,若设该晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度是 g/cm3.(只要求列出算式)。
-
(Ⅰ)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol C与A元素的最高价氧化物反应时转移的电子数为_________。
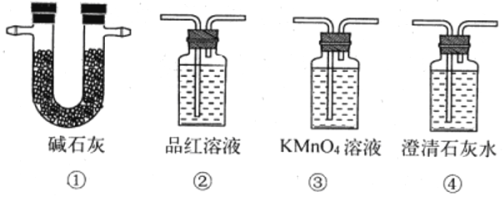
(Ⅱ)、某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按右图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称是_________; 实验过程中,装置B中观察的现象是___________;装置C中有白色沉淀生成,该沉淀是__________(填化学式)。
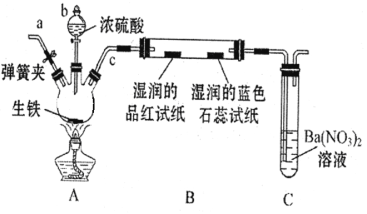
(2)装置A反应容器中还会产生CO2气体,请写出产生CO2的化学方程式__________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是__________。