-
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 |  =4.3×10-7 =4.3×10-7
 =5.6×10-11 =5.6×10-11
| Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
a.  b.
b.  c.
c. 
d.  e.
e. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________(填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
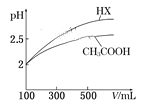
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
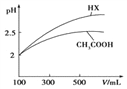
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
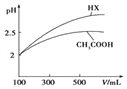
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
-
已知25 ℃时部分弱电解质 的电离平衡常数数据如表所示,回答下列问题:
的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 |  HClO HClO
|
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.
C.c(H+)·c(OH-)
D.
E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)= (填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为_________。
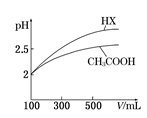
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数___________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
(7)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+_____________________。
②c(H+)+c(Na+)=________________________。
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是___________(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A. c(H+) B.  C. c(H+)•c(OH﹣)
C. c(H+)•c(OH﹣)
D.  E.
E. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=________(填准确数值).
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_________________
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+______________
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH-)/c(H+) E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________。
(4)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_____。
(5)标准状况下,将1.12L CO2通入100mL 1mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH-)=2c(H2CO3)+___。
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B. C. c(H+)•c(OH﹣) D.
C. c(H+)•c(OH﹣) D.  E.
E. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B. C. c(H+)•c(OH﹣) D.
C. c(H+)•c(OH﹣) D.  E.
E. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B. C. c(H+)•c(OH﹣) D.
C. c(H+)•c(OH﹣) D.  E.
E. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=____________。
(2)物质的量浓度均为0.1mol/L的六种溶液:
A.CH3COONa、b.Na2CO3、c.NaClO、D.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为___________(用编号填写)。
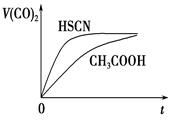
(3)25℃时,将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=________mol/L(填代入数据后的计算式,不必算出具体数值)。
c(CN-)/c(HCN)=____________(填代入数据后的计算式,不必算出具体数值)。
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为_____________。
(6) 25C时,0.18mol/L醋酸钠溶液的pH约为______________。
的电离平衡常数数据如表所示,回答下列问题:




