-
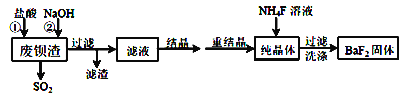
利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:

已知:Kap(BaS2O3)=6.96×10-11,Kap(BaF2)=1.0×10-6
(1)步骤①除产生SO2外,还有淡黄色固体生成,该反应的离子方程式为______________。
(2)步骤②的目的是中和过量的盐酸,加入NaOH溶液不宜过量,其原因是__________(用离子方程式表示)。
(3)滤液的主要成分是BaCl2,还含有少量NaCl,溶解度数据如下表:
| 温度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| NaCl | 36.0g | 36.6g | 37.3g | 39.0g | 39.8g |
| BaCl2 | 35.8g | 40.8g | 46.2g | 52.5g | 59.4g |
步骤③宜采用_____ (填“蒸发结晶”或“降温结晶”)。
(4)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为__________。
(5)步骤④生成BaF2的反应类型为____________。
①若该反应温度过高,容易造成c(F-)降低的原因是__________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度,将浓度为0. 1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________ mol·L-1。
-
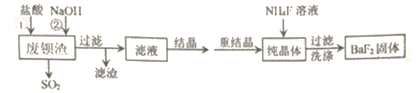
利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
已知:Ksp(BaS2O3)=6.96×10-11,Ksp(BaF2)=1.0×10-6
(1)加入盐酸时除产生SO2外,还有淡黄色固体生成。该反应的离子方程式为___________________________________________________________。
(2)滤液的主要成分有____________。(填化学式)
(3)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为_____________。
(4)加入NaOH溶液的目的是中和过量的盐酸,但不宜过量,其原因是____________(用离子反应方程式表示)。
(5)生成BaF2的反应的化学方程式为_________________________。
①若该反应温度过高,容易造成c(F-)降低的原因是_______________________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度。将浓度为0.1 mol•L-1的BaCl2溶液和0.22mol•L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________。
-
利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
已知:Ksp(BaS2O3)=6.96×10-11,Ksp(BaF2)=1.0×10-6
(1)加入盐酸时除产生SO2 外,还有淡黄色固体生成。该反应的离子方程式为____________。
(2)滤液的主要成分有_____________。(填化学式)
(3)工业上可用氨水吸收SO2,并通入空气使其转化为氨态氮肥。该转化中氧化剂与还原剂的物质的量之比为_______________。
(4)加入NaOH 溶液的目的是中和过量的盐酸,但不宜过量,其原因是_____________(用离子反应方程式表示)。
(5)生成BaF2的反应的化学方程式为______________。
①若该反应温度过高,容易造成c(F-)降低的原因是___________________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度。将浓度为0.1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=______mol·L-1。
-
以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:
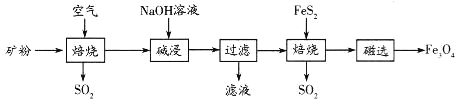
下列说法错误的是
A. 用NaOH溶液吸收焙烧过程产生的SO2有利于保护环境和资源再利用
B. 从高硫铝土矿中可制得Al、Fe的化合物
C. 向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由AlO转化为Al3+
D. FeS2与Fe2O3混合后在无氧条件下焙烧的目的是生成Fe3O4和SO2
-
海洋深处有丰富的软锰矿,以此为主要原料生产MnSO4的工业流程如下:
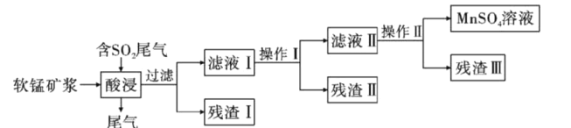
已知:①软锰矿的主要成分是MnO2,此外还含有Fe2O3、Al2O3、CuO、NiO、SiO2等少量杂质。
②几种离子沉淀时数据信息如下:
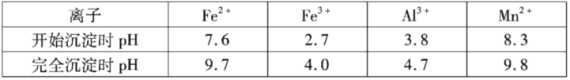
(1)写出酸浸过程中SO2与MnO2反应的离子方程式___________。
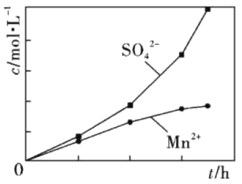
(2)为了探究MnO2与SO2反应情况,某研究小组将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(SO42-)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(SO42-)的变化产生明显差异的原因是___________。
(3)操作I是“除铁铝”,其主要步骤为向滤液I中加入软锰矿,调节p=5.2~6.0左右,使其Fe3+、Al3+沉淀完全,再加入活性炭搅拌、抽滤。写出滤液I中生成Fe2+相关的离子方程式___________、___________。
(4)操作Ⅱ是“除铜镍”,其主要步骤为:向滤液Ⅱ中加入MnS(难溶物),充分搅拌,过滤。加入MnS能除去滤液Ⅱ中Cu2+和Ni2+的原因是___________。
(5)以MnSO4溶液为原料可通过电解法制备超级电容器材料MnO2,其装置如图所示:
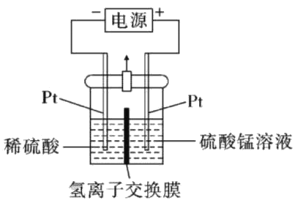
则电解过程中阳极电极反应式为___________,电解一段时间后,阴极溶液中H+的物质的量___________(填“变大”、“减小”或“不变”)。实际生产过程中___________(填“能”或“不能”)用MnCl2溶液代替MnSO4溶液。
-
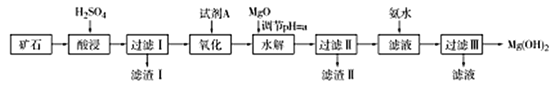
Mg(OH)2可用作塑料的阻燃剂。现以某矿石(主要成分为3MgO·2SiO2·2H2O,还有少量Fe2O3、FeO、CaO和Al2O3)为原料生产,其工艺流程如下:
已知:
表1生成氢氧化物沉淀的pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
表2原料价格表
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
回答下列问题:
(1)酸浸时,为提高矿石的浸出率可采取的措施为_________(任写一条)。该过程H2SO4适当过量的目的是_______________、_________________。
(2)工业生产要求生产成本较低,产品尽量不含杂质。试剂A的最佳选择是______,写出其发生反应的离子方程式_______________________。
(3)水解过程需调节溶液pH,a的取值范围为______,滤渣II的成分是______(填化学式)。
(4)向过滤II所得滤液中加入一定量氨水,写出镁离于沉淀的离子方程式____________,该过程温度不宜过高的原因是_____________________。
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法_____________
-
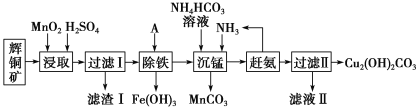
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。
-
以冶炼金属铝的废弃物铝灰为原料制取超细 -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
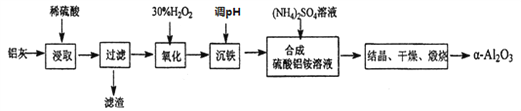
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。
(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
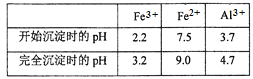
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O]  2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
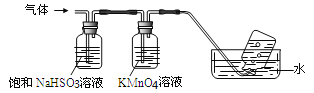
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
-
以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。
(2)流程中加入H2O2有气体产生,原因是___________________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
| Fe3+ | Fe2+ | Al3+ |
| 开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为______________。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
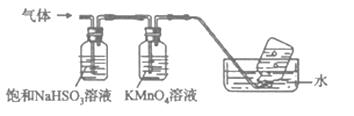
①集气瓶中收集到的气体是____________(填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________mol·L-1(填具体数字计算式,不必化简)

















