-
(16分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸, 总反应为:
总反应为:
2CH3CHO + H2O === CH3CH2OH + CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
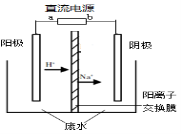
(1)若以甲醇燃料电池为该电解的直流电源,燃料电池中的电解液是氢氧化钠溶液,则燃料电池中b极的电极反应式为 。电池工作一段时间后,氢氧化钠溶液物质的量浓度 (填变大,变小或不变)
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。阳极电极反应如下:① 4OH- - 4e-== O2↑+ 2H2O;②
(3)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(4)若直流电源使用新型的熔融碳酸盐燃料电池(MCFS),该电池以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
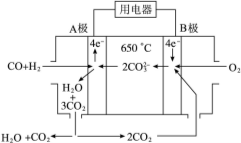
①B极发生______(填“氧化”或“还原”)反应,电极反应式 。
②以此电池电解足量的CuSO4溶液,当电池消耗1.12L(标准状况下)氧气时,则阴极产物的质量为_ _____ g。加入一定量的 可以让CuSO4溶液回复原状。
A、CuO B、Cu(OH)2 C、CuCO3 D、Cu
-
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
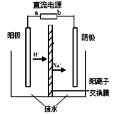
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO 42-)+c(CH3COO-)+c(OH-)
42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:
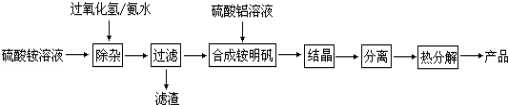
①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
-
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO + H2O CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如右图所示。
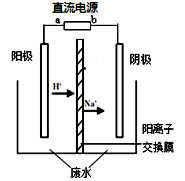
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O
② 。
阴极:① 。
②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a. c(Na+)不一定是c(SO42- )的2倍
b. c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c. c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d. c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
-
如图所示装置可处理乙醛废水,乙醛在阴 、阳极分别转化为乙醇和乙酸。下列说法正确的是( )
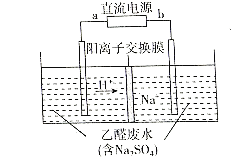
A. b电极为正极
B. 电解过程中,阴极区Na2SO4的物质的量增大
C. 阳极电极反应式为CH3CHO-2e-+H2O=CH3COOH+2H+
D. 电解过程中,阴、阳极还分别产生少量的O2和H2
-
图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是( )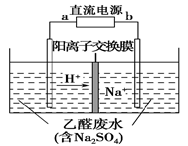
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+
D.电解过程中,阴、阳极还分别产生少量的O2和H2
-
图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是
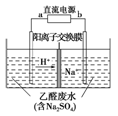
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+
D.电解过程中,阴、阳极还分别产生少量的O2和H2
-
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
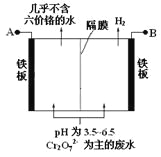
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++ 7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
-
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右,下列说法不正确的是

A.A为电源正极
B.阴极区附近溶液pH降低
C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收 集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列
说法正确的是( )。
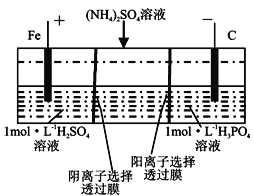
A. 阳极室溶液由无色变成棕黄色
B. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
C. 电解一段时间后,阴极室溶液中的pH升高
D. 当电路中通过1mol电子的电量时,阴极有0.25mol的O2生成
-
(13分)CH3CHO是有毒物质,易溶于水,含高浓度CH3CHO的废水可以用隔膜电解法处理,总反应为:
2CH3CHO(l) + H2O(l)  CH3CH2OH(l) + CH3COOH(l) ;△H
CH3CH2OH(l) + CH3COOH(l) ;△H
(1)依次写出该反应中三个有机物的官能团名称_____、_______、_______(每空1分)
(2)已知CH3CH2OH、CH3CHO、CH3COOH的燃烧热分别为1366.8 kJ/mol、1166.4kJ/mol、874.8kJ/mol,则△H=_____________
(3)现在实验室中模拟乙醛废水的处理过程,模拟废水为一定浓度的乙醛—Na2SO4溶液,其装置示意图如下图所示。
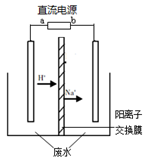
①b是直流电源的______极。
②Na2SO4的作用是_______________________________________。
③阳极除去乙醛的电极反应为________
(4)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后1位)。
CH3CH2OH + CH3COOH











