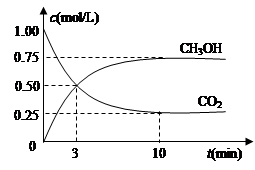-
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇, 一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)写出该反应的平衡常数表达式:K= ;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(2)下列情况不能说明该反应一定达到平衡的是
A混合气体的平均平均相对分子质量不变 B混合气体的压强不变
C单位时间内生成3mol H—H键,同时生成2 mol C=O键
D.混合气体中 c (H2) : c (CH3OH) = 3:1
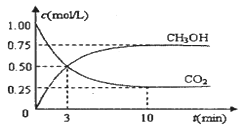
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1
(4)下列措施中能使(3)题中n(CH3OH)/n(CO2)增大的有 。(填字母)
A升高温度 B加入催化剂 C将H2O(g)从体系中分离
D充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(5)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与(3)题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________ (3)题中的CO2的体积百分数。(填“>”或“<”或“=”)
-
(4分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
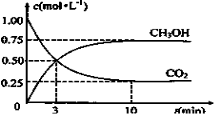
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到10min,氢气的平均反应速率v(H2)=
(2)下列说法正确的是________
A、进行到3分钟时,正反应速率和逆反应速率相等。
B、10分钟后容器中压强不再改变。
C、达到平衡后,再充入氩气反应速率不会改变。
D、3min前v正>v逆,3min后v正<v逆。
-
(10分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
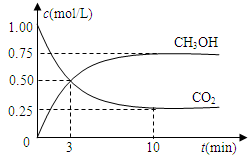
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
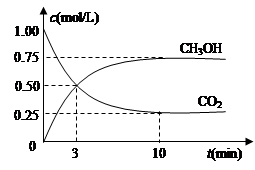

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
(2)该条件下的平衡常数为__________________。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
-
、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
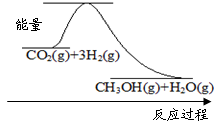
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。

①在反应进行的0~1min内,该反应的平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),反应将向着能够减弱这种改变的方向进行(如增大H2的浓度,反应向右进行以减弱外界条件增大H2的浓度的影响)直至达到新的平衡。若上述反应体系不改变反应物的物质的量,仅分别改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH
-
2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(1)判断该反应达到平衡的标志是
A.CO2和甲醇的浓度相等
B.CO2的百分含量保持不变
C.容器内压强保持不变
D.容器内混合气体的密度保持不变
(2)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min),二氧化碳的转化率为 .
-
(实验班做)(15分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)  CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为 ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为 (保留两位小数),若提高温度到800℃进行,达平衡时,K值 (填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正) v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
-
(9分)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有:________。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2 b.CO2 + 3H2
C6H12O6+6O2 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是________,原子利用率最高的是________。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
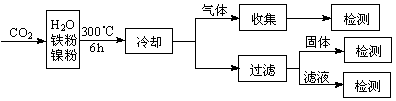
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
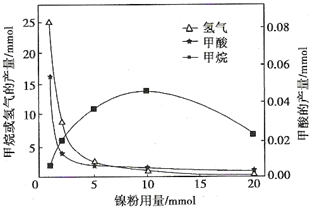
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2 HCOOH
HCOOH CH4
CH4
①写出产生H2的反应方程式________。
②由图可知,镍粉是________。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂 c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是________。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
-
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有________(填字母)。
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是____________,原子利用率最高的是_________。
-
CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的结构式___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
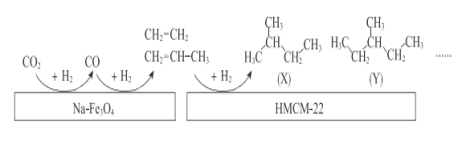
①Na-Fe3O4和HMCM-22 在反应中的作用为___________
②写出(X)的所有同分异构体结构简式___________
③关于X和Y的说法正确的是_______(填序号)。
A.最简式相同 B.都有4种一氯代物
C.都易使酸性KMnO4溶液褪色 D.X和Y互称同分异构体
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出烷烃(M)的结构简式____其与氯气反应生成一氯代烃的方程式________。
 CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。