-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
①,
②________,

③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=________。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=________。
-
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
-
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
-
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
-
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
-
(13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
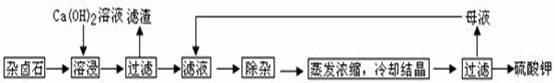
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,________
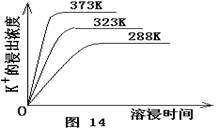
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应的平衡常数K 。
-
难溶性杂卤石属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
(1)滤渣主要成分有______和______以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:______.
(3)“除杂”环节中,先加入______溶液,经搅拌等操作后,过滤,再加入______溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①______②______;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K______ (计算结果保留三位有效数字).
-
Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s)  Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
A.NaOH固体 B.NaCl固体
C.MgSO4固体 D.NaHSO4固体
-
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)  Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
-
氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固
体的量减少,可加入少量的( )
A. NaOH B. NH4Cl C. MgSO4 D. NaHSO4
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:


CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=________。








