-
实验室从废电路板粉碎金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)中回收铜,其实验流程如下:
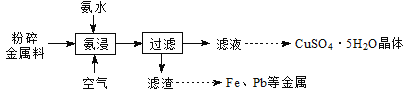
已知:一定pH范围内,Cu2+、Zn2+等能与氨形成配离子。
(1)“氨浸”在题图-1所示的装置中进行。
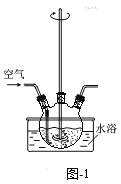
①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,其离子方程式为________;
②空气流量过大,会降低Cu元素的浸出率,其原因是_____________。
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,有利于Cu2+转化为[Cu(NH3)4]2+,其原因是_________。
(2)洗涤滤渣所得的滤液与“过滤”所得滤液合并的目的是________________。
(3)滤液中主要阳离子为[Cu(NH3)4]2+、NH ,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)  Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)  CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
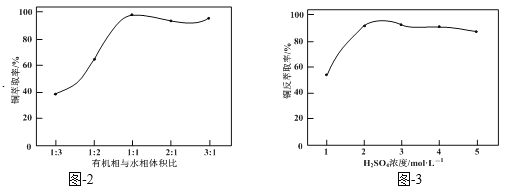
结合题图-2和题图-3,补充完整以滤液为原料,制取较纯净CuSO4·5H2O晶体的实验方案:_______,蒸发浓缩,冷却结晶,过滤洗涤干燥。(实验中可选用的试剂:有机溶剂HR、2mol·L−1硫酸、3mol·L−1硫酸)。
-
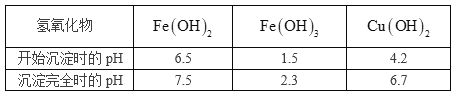
孔雀石的主要成分是 ,还含有少量
,还含有少量 、
、 等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:
等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:
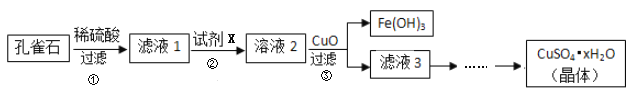
已知相关氢氧化物沉淀的pH范围如下:
完成下列填空:
(1)滤液1中含有的金属阳离子有_______________。
(2)步骤②中所用的试剂X是________(选填编号)。
a. Fe粉 b.  c. 氨水 d. KSCN
c. 氨水 d. KSCN
(3)步骤③中加入CuO的目的是________________________________________。
(4)由滤液3得到硫酸铜晶体,需要经过的步骤依次有:_________、________、过滤等。
(5)为测定所得晶体中结晶水的 值,可采用加热法。取
值,可采用加热法。取 g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
①晶体应盛装在________(填仪器名称)中进行灼烧。
②确认结晶水已全部失去的方法是___________________________。
③ 值的表达式为______________(用
值的表达式为______________(用 、
、 表示)。
表示)。
④实验结果发现测得结晶水数量 偏高,可能的原因有___________(任写一种)。
偏高,可能的原因有___________(任写一种)。
-
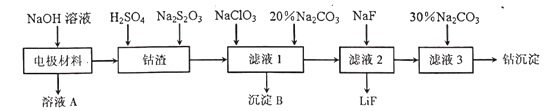
金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下
请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
-
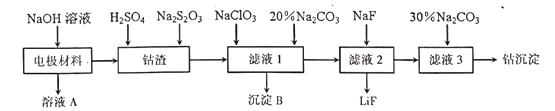
金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下
请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)“溶液A”中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液1”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
-
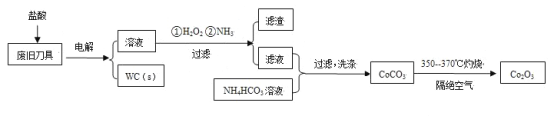
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
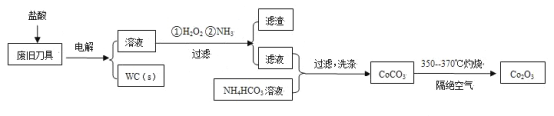
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 1.9 | 7.0 | 6.5 |
| 沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
-
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 1.9 | 7.0 | 6.5 |
| 沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
-
以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:
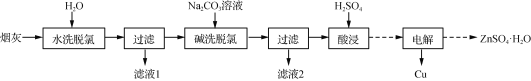
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
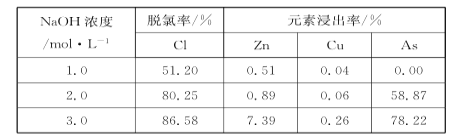
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
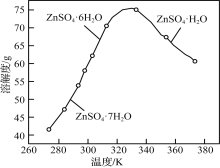
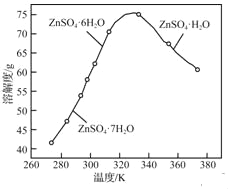
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
-
以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4•H2O,其主要实验流程如下:
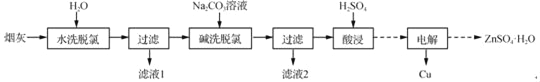
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
| NaOH浓度/mol•L﹣1 | 脱氯率/% | 元素浸出率/% |
| Cl | Zn | Cu | As |
| 1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
| 2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
| 3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4•H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15g•L﹣1、0.58g•L﹣1,可采用“氧化中和共沉淀”法除去,请设计实验方案:_____(实验中须使用的试剂有:30%双氧水,0.001mol•L﹣1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
-
废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下图。
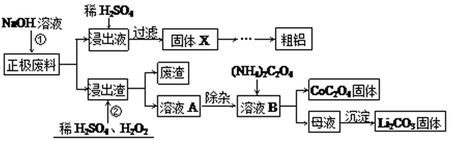
已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
(1)写出步骤①中溶解铝的离子方程式:___________________,写出固体X到粗铝过程中所涉及的化学方程式:________________________。
(2)步骤②加入H2SO4和物质Y,物质Y可能为________(填序号)。
a.KMnO4溶液 b.稀硝酸溶液 c. H2O2溶液
写出步骤②中LiCoO2固体溶解的化学方程式:_______________________。
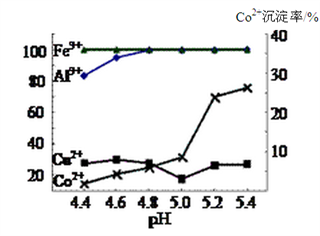
(3)实验表明溶液A中各种金属离子的沉淀虑随pH的变化如下图,现向溶液A中加入氨水,除去杂质离子________(填离子符合),应调节pH范围为_____________。
(4)母液中主要的溶质为_________________。
(5)从2kg锂离子电池正极材料(Li元素含量为7%)中可回收LiCO3的质量为_______g。(已知回收率为85%)
-
废旧锂离子电池的回收利用的意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下:
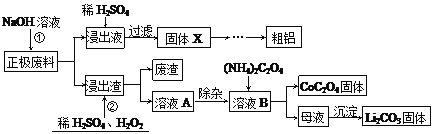
已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
(1)步骤①中铝溶解的离子方程式为_________________,固体X的成分是_________。
(2)步骤②中LiCoO2固体溶解的化学方程式为_______________ ,该反应的还原剂是_______。
(3)母液中含量最大的三种离子是_________。
(4) (NH4)2C2O4是一种化学实验室常用的试剂,预测其溶解性___________(填“可溶于水”或“不溶于水”)。一定温度下,(NH4)2C2O4固体可分解出NH3和CO等物质,思考其它的产物并写出其分解的化学方程式__________________。


,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。














