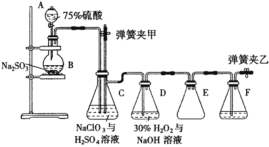
-
NaClO2( 亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是

A.若直流电源为铅蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-=ClO2-
C.交换膜左测NaOH 的物质的量不变,气体X 为Cl2
D.制备18.1g NaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
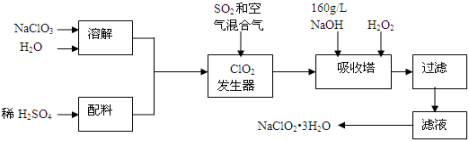
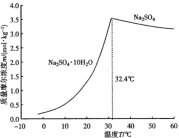
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为 。
(3)吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是 (填序号)。
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简)
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
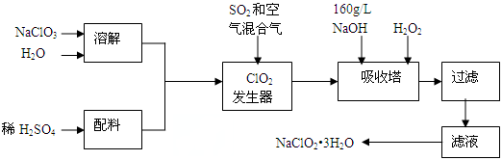
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中发生反应的离子方程式为 。发生器中鼓入空气的作用可能是 。
A.将SO2氧化成SO3,增强酸性
B.将NaClO3还原为ClO2
C.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为 ;吸收塔内的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
A.Na2O2 B.Na2S C.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_____________________。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
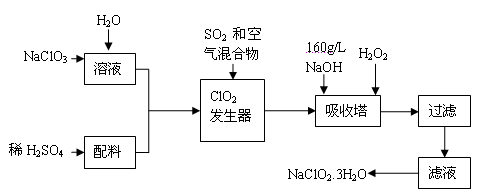
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
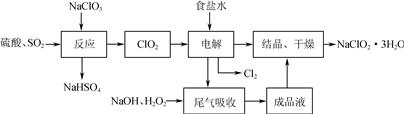
回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。
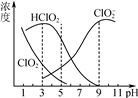
(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
-
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
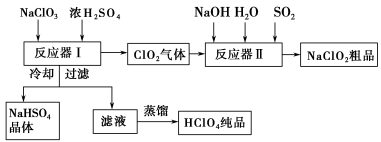
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
-
NaClO2 是一种重要的杀菌消毒剂,工业上制备 NaClO2 的原理为 ClO2+H2O2+NaOH→NaClO2+H2O+O2(未配平)。下列说法正确的是( )
A.该制备反应中,O2 是氧化产物
B.氧化剂与还原剂的物质的量之比为 1:2
C.生成标准状况下的 11.2L 气体,转移 2mol 电子
D.制备过程中,混合液的 pH 降低
-
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效、安全的消毒剂。实验室以NH4Cl、盐酸和NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示。
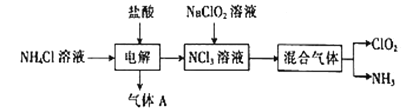
请回答下列问题:
(1)ClO2中Cl的化合价是________________________。
(2)写出电解时发生反应的化学方程式:____________________________。
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应的氧化剂与还原剂的物质的量之比为______;若产生11.2L(标准状况)NH3,则转移电子的总数为___NA。
(4)二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中的Fe3+和Mn2+,写出C1O2将Mn2+氧化为MnO2的离子方程式(C1O2反应后的产物为Cl-):_________________。
-
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
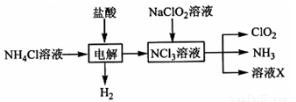
(1)电解时的阳极反应方程式为____________________________________。
(2)除去ClO2中的NH3可选用的试剂为是_____(填标号)
A.水 B.浓硫酸 C.碱石灰 D.饱和食盐水
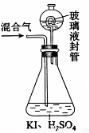
(3)用右图装置可以测定混合气中ClO2的含量:
I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸;
II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III.将一定量的混合气体通入锥形瓶中吸收;
IV.将玻璃液封装置中的水倒入锥形瓶中;
V.用0.2000mol/L 硫代酸钠标准溶液滴定锥形瓶中的溶 液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
①玻璃液封装置的作用是_________。
② V中加入的指示剂通常为______,滴定至终点的现象是______。
③测定混合气中ClO2的质量为______g。
④用此方法测定混合气中ClO2的质量常常偏高,可能的原因是_____(用离子方程式表示)。
-
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
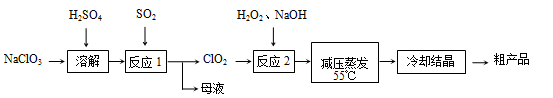
(1)“反应2”的还原剂是____________,写出它的电子式 ,该反应的化学方程式为 ,原因是___________________。
(3)从“母液”中可回收的主要物质是 。
(4)“冷却结晶”后经___________(填操作名称)即可获得粗产品。