捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.HOCH2CH2NH2 C.CH3CH2OH D.NH4Cl
(2)工业上用NH3捕碳可合成CO (NH2)2:
已知:①标准状况下,11.2L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g) 的△H=_____________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:
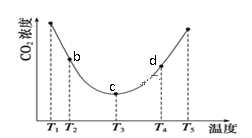
(NH4)2CO3(aq)+H2O(l)+CO2(g)  2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
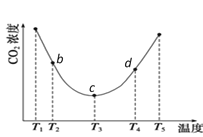
①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 _____________。(填“>”、“=”或“<”)
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是________。
(4)用碱性溶液也可捕碳:在常温下,将0.04mol CO2通入200mL 0.2mol/L的Na2S溶液中,已知: H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题
①发生反应的离子方程式为_____________________________
②充分反应后下列关系式中正确的是_____________________
A.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
C.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
③计算反应后的溶液中c(H2S).c(OH-)/c(HS-)的值为______________
高三化学综合题中等难度题