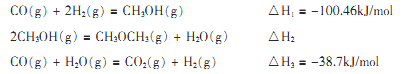-
二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-55.7 kJ/mol
②2CH3OH(l) =CH3OCH3(g)+H2O (l) ΔH2=-23.4 kJ/mol
③CO2 (g)+H2(g) =CO(g) + H2O (l) ΔH3
④H2O (l) = H2O (g) ΔH4=+ 44.0 kJ/mol
(1)已知反应CO2 (g)+H2(g) =CO(g) + H2O (g) ΔH,中相关的化学键键能数据如下:
| 化学键 | H-H | C O O | H-O | C-H | C=O |
| E/(kJ·mol-1) | 436 | 1076 | 465 | 413 | 745 |
由此计算ΔH=______________,则ΔH3 =________________。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是_______________________。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示,图中A点和B点的平衡常数比较:
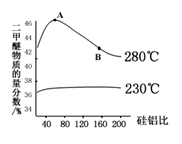
KA________KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:___________________。
(4)常温常压下,向一个2.00 L的密闭恒容容器中加入等量2.00 mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150 mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)。
-
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
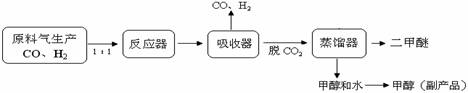
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H =________
CH3OCH3(g)+CO2(g),则该反应的△H =________
②下列有关反应Ⅲ的说法正确的是________
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是________。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是________。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
(3) 二甲醚也可以通过CH3OH分子间脱水制得
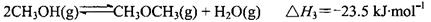
在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
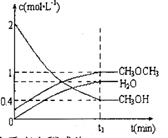
①该条件下反应平衡常数表达式K=______根据图中数据计算 时该反应的平衡常数为 ________
时该反应的平衡常数为 ________
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为:
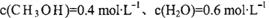 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。
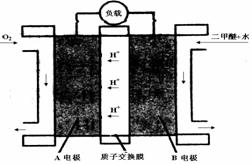
请回答下列问题:
①A电极是________极。
②B电极上发生的电极反应式是 ________________。
-
I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:
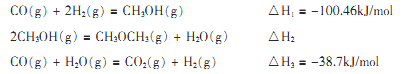
则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为
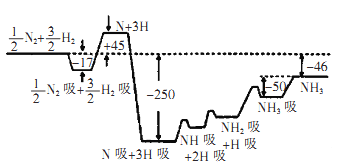
①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3  NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
-
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2 O2):2CO( g)+4H2(g)
g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
-
(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
(2) 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
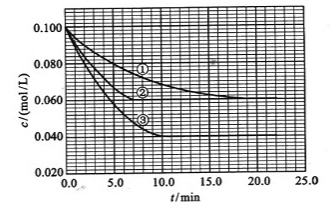
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;______________________________________________;
③_______________________________________________;
该反应的 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
-
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是________(填字母代号)。
A.降低温度 B.加入催化剂
C.缩小容器体积 D.增加H2的浓度
E.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________。
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g)的ΔH= ___________;
CH3OCH3(g) + CO2(g)的ΔH= ___________;
(2)已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”);
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _______________,该时间内反应速率v(CH3OH) = __________________;
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
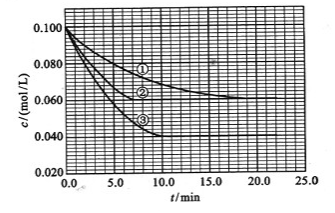
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②________________________________________________________________________;
③________________________________________________________________________;
该反应的 _________0,判断其理由是______________________________________________;
_________0,判断其理由是______________________________________________;
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为______________________.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ________;
CH3OCH3(g)+CO2(g) 的△H= ________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小比较: _________
_________ (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的汽化的主要化学方程式为________。
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)已知反应2CH3OH(g)  CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
①通过计算比较此时正、逆反应速率的大小?
②若加入CH3OH后,经10min反应达到平衡,试计算此时CH3OH的物质的量浓度和该时间内CH3OH的化学反应速率?



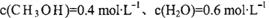 、
、