-
已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
温度/℃
V(H2C2O4)
/mL
V(KMnO4)
/mL
V(H2O)
/mL
KMnO4溶液
褪色时间/s
1
30
10
10
20
40
2
30
20
20
0
t
3
30
15
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
高二化学填空题困难题查看答案及解析
-
(13分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①
在酸性环境下的还原产物是
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入
的草酸溶液
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
实验
编号
反应温度
(利用水浴加热)
稀硫酸溶液
固体
溶液
褪色时间
1
65℃
—
—
1.0mL
100s
2
65℃
10滴
—
1.0mL
90s
3
75℃
10滴
—
1.0mL
40s
4
75℃
10滴
加入少许
1.0mL
3s
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体
样品
;配制成
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述
溶液与酸性
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
高二化学实验题简单题查看答案及解析
-
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①
在酸性环境下的还原产物是
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入
的草酸溶液
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
实验
编号
反应温度
(利用水浴加热)
稀硫酸溶液
固体
溶液
褪色时间
1
65℃
—
—
1.0mL
100s
2
65℃
10滴
—
1.0mL
90s
3
75℃
10滴
—
1.0mL
40s
4
75℃
10滴
加入少许
1.0mL
3s
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体
样品
;配制成
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述
溶液与酸性
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
高二化学实验题简单题查看答案及解析
-
草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
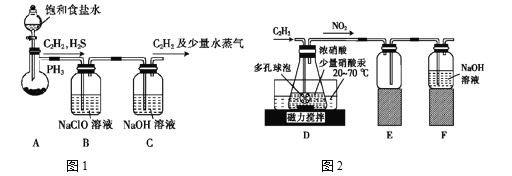
①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
高二化学综合题中等难度题查看答案及解析
-
草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
高二化学实验题中等难度题查看答案及解析
-
草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
高二化学实验题中等难度题查看答案及解析
-
碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3
H2C2O4
K1
4.2×10−7
5.4×10−2
K2
5.6×10−11
5.4×10−5
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________。
②浓度均为0.1 mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________。
(2)常温时,C和CO的标准燃烧热分别为−394.0 kJ·mol−1、−283.0 kJ·mol−1,该条件下C转化为CO的热化学方程式为____________________。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)
CH3OH(g) ΔH=Q kJ·mol−1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃
250
300
350
K/L2·mol−2
2.041
0.270
0.012
由此可判断Q______(选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L−1,该温度下的平衡常数K=____,0~10 min内反应速率v(CH3OH)=______。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:
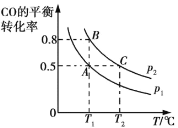
若A点对应容器的容积为20 L,则B点对应容器的容积为____L。
高二化学综合题中等难度题查看答案及解析
-
乙二酸(H2C2O4)俗名草酸,是一种有还原性的有机二元弱酸。
(1)一同学在做“研究温度对化学反应速率的影响”实验时,他往a、b两支试管中均加入5.0mL 0.01mol▪L-1的酸性KMnO4溶液和2.0mL 0.1mol▪L-1H2C2O4溶液,振荡,a试管置于热水中,b试管置于冷水中,记录溶液褪色所需的时间。
①褪色所需时间ta________(填“>”“=”或“<”)tb;
②写出该反应的离子方程式:__________________________________。
(2)配制250mL乙二酸溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
①滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol▪L-1 KMnO4标准溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作;
②判断滴定达到终点的现象是____________________________________________。
③这位同学共重复滴定操作了3次,记录实验数据如下表:
序号
滴定前读数/mL
滴定后读数/mL
1
0.50
20.51
2
1.50
21.49
3
0.32
21.85
则这位同学计算得到此样品的纯度为_________。
高二化学实验题中等难度题查看答案及解析
-
(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序
KMnO4溶液紫色褪去所需的时间
先滴入第1滴
60s
褪色后,再滴入第2滴
15s
褪色后,再滴入第3滴
3s
褪色后,再滴入第4滴
1s
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)
和
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
随c(H+)的变化如图所示
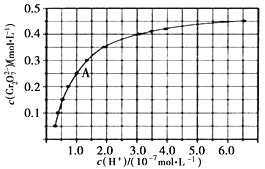
①用离子方程式表示溶液中
和
的转化反应_________。
②由图可知,溶液酸性减小,
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
高二化学综合题中等难度题查看答案及解析
-
(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序
KMnO4溶液紫色褪去所需的时间
先滴入第1滴
60s
褪色后,再滴入第2滴
15s
褪色后,再滴入第3滴
3s
褪色后,再滴入第4滴
1s
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)
和
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
随c(H+)的变化如图所示

①用离子方程式表示溶液中
和
的转化反应_________。
②由图可知,溶液酸性减小,
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
高二化学综合题中等难度题查看答案及解析