-
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) = CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为 。
(2)若反应2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①写出该反应的平衡常数表达式:K= 。
②比较该时刻正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)= 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:
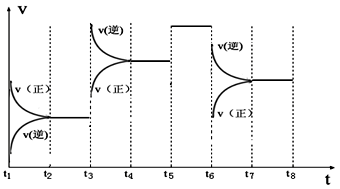
各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
K4、K5、K6、K7之间的关系为 (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是 。
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
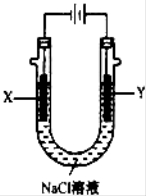
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小 ”或“不变”,下同)。
”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式  ;
;
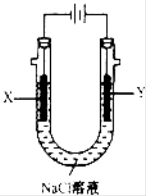
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚 燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3 的产率将 (填“变
的产率将 (填“变 大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)写出二甲醚燃烧热的热化学方程式_______________________________________________;当燃烧放出582kJ热量时,转移的电子数为_______________。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为______________________________;
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______________________________(选填字母编号)
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将_______________(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_______________。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)当燃烧放热582kJ热量时,转移的电子数为___。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mol;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为__;
(3)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)⇌CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是__(选填字母编号)
A.c(H2)与c(H2O)的比值保持不变
B.单位时间内有2molH2消耗时有1molH2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将__(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将__。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。
请填写下列空白:
(l)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:_____________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:______________________________。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:_________________________。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。请填写下列空白:
(1)二甲醚的核磁共振氢谱图中有 个吸收峰,官能团名称是 。
(2)二甲醚的同分异构体A与浓硫酸混合,加热到170℃时生成有机物B:
①写出A的官能团电子式为 ;B与溴水反应生成的物质名称为 ;
②德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应而获得1950年诺贝尔化学奖,该反应是一种环加成反应:凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一请根据以上信息写出2-甲基-1,3-丁二烯(含共轭双烯体系)与B反应化学方程式 。
(3)二甲醚、空气、氢氧化钾溶液、多孔石墨电极构成燃料电池,则负极电极反应式是 。
(4)反应2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为225 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为225 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:

①比较此时正、逆反应速率的大小:v(正) ______ v(逆)(填“>”、“<”或“=”);
②若开始只加入CH3OH,经10min后反应达到平衡,计算达到平衡时CH3OH转化率 α(CH3OH)= (计算结果用百分数表示,保留小数后一位)。
-
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行。二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。有关说法正确的是
A.二甲醚与乙醇是同分异构体
B.该燃料电池中通入二甲醚的一极为正极
C.二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染
D.在燃料电池中二甲醚最终转化为CO2和H2O
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:



