-
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值。注意阅读分析材料,据此完成下列要求。
元素
H
Li
Be
B
C
N
O
F
电负性
2.1
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.7
2.1
2.3
3.0
0.8
(1)预测周期表中电负性最大的元素应为________(填元素符号);估计钙元素的电负性的取值范围:________<X<________。
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系________
________。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为________;上表中最易形成离子键的两种元素的电负性之差为________。
高二化学填空题困难题查看答案及解析
-
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值。注意阅读分析材料,据此完成下列要求。
元素
H
Li
Be
B
C
N
O
F
电负性
2.1
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.7
2.1
2.3
3.0
0.8
(1)预测周期表中电负性最大的元素应为 (填元素符号);估计钙元素的电负性的取值范围: <X< 。
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。
高二化学填空题困难题查看答案及解析
-
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
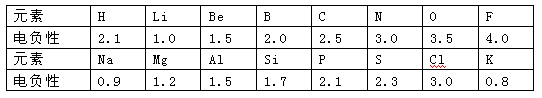
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围:________< X <________。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是________
________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系________。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为________。
高二化学填空题困难题查看答案及解析
-
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素
H
Li
Be
B
C
N
O
F
电负性
2.1
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.7
2.1
2.3
3.0
0.8
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。
高二化学填空题简单题查看答案及解析
-
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素
H
Li
Be
B
C
N
O
F
电负性
2.1
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.7
2.1
2.3
3.0
0.8
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是______________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。
高二化学综合题中等难度题查看答案及解析
-
1932年美国化学家鲍林首先提出电负性的概念.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题;元素 H Li Be B C N O F 电负性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0 元素 Na Mg Al Si P S Cl K 电负性 0.9 1.2 1.5 1.7 2.1 2.3 3.0 0.8
(1)预测周期表中电负性最大的元素应为______;估计钙元素的电负性的取值范围:______<X<______.
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化______; 简述元素电负性X的大小与元素金属性、非金属性之间的关系______.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为______,其理由是______.高二化学解答题中等难度题查看答案及解析
-
1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
x 值
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
⑴通过分析 x 值变化规律,确定N、Mg的 x 值范围:
________<x (N)<________, ________<x (Mg)<________.
⑵某有机化合物结构中含S-N键,其共用电子对偏向________(写原子名称).
⑶经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键.试推断AlBr3中化学键类型是________.
⑷预测周期表中,x 值最小的元素位于________周期________族.(放射性元素除外)
高二化学填空题困难题查看答案及解析
-
(8分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
x 值
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
(1)通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< 。
(2)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键,试推断AlBr3中化学键类型是 。
(4)预测周期表中,x 值最小的元素位于 周期 族。(放射性元素除外)
高二化学填空题中等难度题查看答案及解析
-
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
?
2.1
2.3
3.0
0.8
A 钙元素的电负性的取值范围在0.8与1.2之间
B. 硫化钠的电子式为
C 硅元素的电负性的取值范围 在1.5与2.1之间
D Al与S形成的化学键可能为共价键
高二化学选择题简单题查看答案及解析
-
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
H:2.1
Li:1.0
Be:1.5
B:2.0
C:2.5
N:3.0
O:3.5
F:4.0
Na:0.9
Mg:1.2
Al:1.5
Si:1.8
P:2.1
S:2.5
Cl:3.0
K:0.8
Ca:1.0
Ga:1.6
Ge:1.8
As:2.0
Se:2.4
Br:2.8
Rb:0.8
Sr:1.0
In:1.7
Sn:1.8
Sb:1.9
Te:χ
I:2.5
Cs:0.7
Ba:0.9
Tl:1.8
Pb:1.9
Bi:1.9
Po:2.0
At:2.2
Fr:0.7
Ra:0.9
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理【解析】
________;________⑵预测Te元素χ的值________;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小?________;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程________。
高二化学填空题简单题查看答案及解析