-
Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S ↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O |
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL |
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
| | | | | | |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
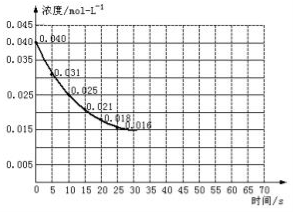
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。
-
下列说法正确的是
A.理论上任何放热的反应均能设计成为原电池
B.实验室研究反应条件对速率的影响,硫代硫酸钠稀溶液与稀硫酸反应Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,常根据产生气泡的快慢判断反应速率的快慢
C.恒温恒容,2molSO2(g)与1molO2(g)充分反应放出热量是aKJ,则该反应的热方程式是2SO2(g)+O2(g) 2SO3(g) △H = -akJ/mol
2SO3(g) △H = -akJ/mol
D.对于有气体参加的某放热反应,使用合适催化剂或增大压强(减小体积)均增加了单位体积内活化分子数目从而加快反应速率
-
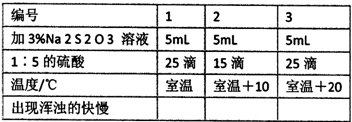
已知硫代硫酸钠溶液和稀硫酸反应可析出单质硫沉淀:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
某同学按下表进行实验,请你判断哪一组先出现浑浊。
-
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究___________对化学反应速率的影响。
(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是___________的影响。若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入________(填字母序号)做对比实验。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
-
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________________对化学反应速率的影响。
(2)已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。
针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_______________________________的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入________(填字母序号)做对比实验。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
-
(10分)
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
-
硫代硫酸钠(Na2S2O3)与稀硫酸溶液作用时发生如下反应:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,下列化学反应速率最大的是( )
A.0.1mol/L Na2S2O3 和0.1mol/LH2SO4溶液各5ml,加水5ml,反应温度10℃
B.0.1mol/L Na2S2O3 和0.1mol/LH2SO4溶液各5ml,加水10ml,反应温度10℃
C.0.1mol/L Na2S2O3 和0.1mol/LH2SO4溶液各5ml,加水10ml,反应温度30℃
D.0.2mol/L Na2S2O3 和0.1mol/LH2SO4溶液各5ml,加水10ml,反应温度30℃
-
I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O |
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL |
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
| | | | | | |
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2 =____________,V3=____________;
(2)若V4=10.0,V5=6.0,则实验①、③可探究____________对反应速率的影响。
Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
(1)滴定应选择的指示剂是____________,滴定终点的现象为____________。
(2)对于该滴定实验的有关操作或误差分析正确的是____________。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
(3)样品中硫代硫酸钠纯度的表达式为____________。
-
己知硫代硫酸钠溶液和稀硫酸反应可析出单质硫沉淀:
Na2S2O3+H2SO4==Na2SO4+S↓+SO2↑+H2O
某同学按下表进行实验,请你判断哪一组先出现浑浊。
-
硫代硫酸钠(Na2S2O3)与稀H2SO4溶液反应:Na2S2O3+H2SO4=Na2SO4+SO2↑十S↓+H2O下列化学反应速率最大的是 ( )
A.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5ml,加水5ml,反应温度10℃
B.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5ml,加水10ml,反应温度10℃
C.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5ml,加水10ml,反 应温度30℃
应温度30℃
D.0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5ml,加水10ml,反应温度30℃
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:


