-
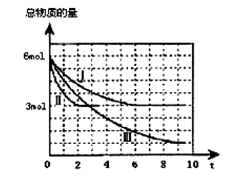
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g)∆H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)∆H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
-
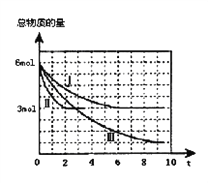
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
(1)能判断反应达到化学平衡状态的是_____(填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E. v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是___________________。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1______T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) =_____mol/(L·min)。②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K=___________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
-
工业上采用CO和H2合成再生能源甲醇,反应为:2H2(g)+CO(g) CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是______(填“高温”、“低温”或“任意温度”)
②下列说法正确的是______。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因______。
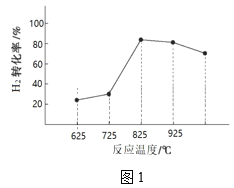
(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=_____k逆。
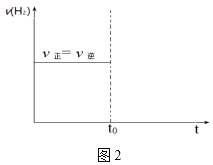
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图像_____。
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式______。
-
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH________0,△S________0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
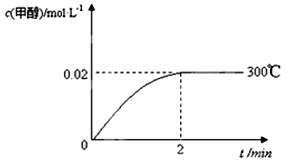
①在0~2min内,以H2表示的平均反应速率为mol·L-1·s-1 ,CO的转化率为________。
②列式计算300℃时该反应的平衡常数K=。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将________。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是________。
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
-
(1)甲醇是可再生能源,具有开发应用的广阔前景,回答下列问题:
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是________(填序号).
A.每消耗1mol CO的同时生成2molH2 B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)________K(B)(填“>”、“=”或“<”).

(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列问题:
① 该反应的热化学方程式是________ ;
② 该反应达到平衡后,升高温度平衡向________ (填“正反应方向”、“逆反应方向”)移动;加入催化剂平衡________(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是________。
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2 B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如下图所示。

A、B两点的平衡常数K(A) K(B)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,
CO的转化率= ,此温度下的平衡常数K= (保留两位有效数字).
-
甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g).图l表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
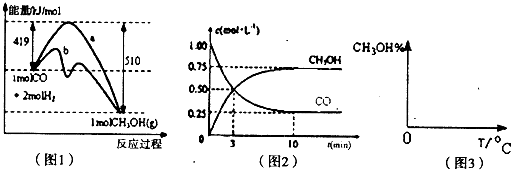
请回答下列问题:
(1)在“图1”中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应.
(2)根据“图2”判断,下列说法正确的是______
a.起始充入的CO为1mol
b.增加CO浓度,可使H2的转化率增大
c.容器中压强恒定时,反应已达平衡状态
d.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=______;该温度下CO(g)+2H2(g)⇌CH3OH(g)的化学平衡常数为______.若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将______(填“增大”、“减小”或“不变”).
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2).
-
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______
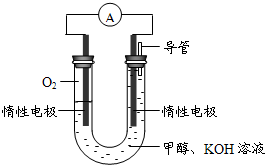
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为______.
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g) CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g) CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
CH3OH(g) ∆H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:








