-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
【答案】 +6 铜 1s22s22p63s23p63d104s24p1 3d64s2 cd bc
【解析】试题分析:(1)I是Cr元素,价电子排布是3d54s1;K是29号元素Cu;(2)Q是31号元素Ga;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小;非金属性越强,最高价氧化物的水化物酸性越强;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1;Ⅷ族的元素,属于d区元素;M的外围电子排布式为5d106s1;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素;
解析:(1)I是Cr元素,价电子排布是3d54s1,所以最高化合价为+6;K是29号元素Cu,名称是铜;(2)Q是31号元素Ga,核外电子排布式是1s22s22p63s23p63d104s24p1;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径G>H>A>B,故a错误;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素,所以第一电离能Ne>F>N>O,故b错误;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小,所以电负性A>H>G>Q,故c正确;非金属性越强,最高价氧化物的水化物酸性越强,最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3>Al(OH)3,故d正确;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1,属于s区元素,故a正确;Ⅷ族的元素,属于d区元素,O位于元素周期表第七周期Ⅷ族,属于d区元素,故b错误;M的外围电子排布式为5d106s1,故c错误;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素,故d正确。
点睛:同周期元素从左到右第一电离能增大,ⅤA族元素p能级为半充满状态,能量低,第一电离能大于相邻的ⅥA族元素,如第二周期的N元素第一电离能大于O。
【题型】综合题
【结束】
23
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)I的最高化合价为________,K的元素名称为________。
(2)基态时Q元素原子的电子排布式_________________________________,J元素原子的外围电子排布式______________________。
(3)下列对比正确的是________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________。
(6)元素B和C的气态氢化物热稳定性较强的是________(填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________,其水溶液颜色为________。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________。
-
(14分)下图是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素:

(1)上述元素的单质中熔点最高的可能是________(填字母)。
(2)在一定条件下,a与e可形成一种简单化合物,其晶体类型为________,空间结构是________;a与d形成的简单化合物中含________键。(填“极性”或“非极性”)
(3)现有另一种元素X,其原子获得一个电子时所释放出的能量比表中所列元素中都要大,则X是________元素,属于周期表中________族元素。
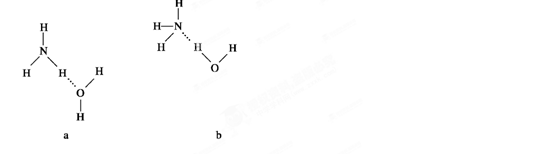
(4)NH3·H2O的电离方程式为 试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
-
如图是元素周期表的一部分,表中所列字母分别代表一种元素
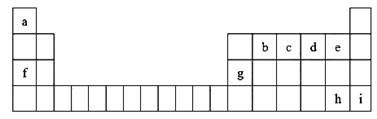
回答下列问题:
(1)h元素的名称是_________,九种元素中金属性最强的是_________(填元素符号)。
(2)f的最高价氧化物对应的水化物的化学式___________(填化学式)。
(3)b、c、d、e的原子半径依次___________(填增大或减小)。
(4)e、h元素的氢化物中,热稳定性大的是_________(填氢化物的化学式)。
(5)工业上冶炼g元素的单质的化学方程式_______________________________。
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
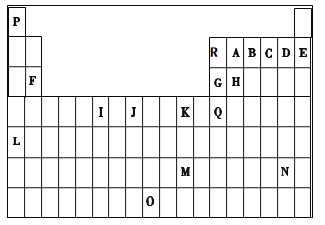
试回答下列问题:
(1)I的最高化合价为__________,J价电子排布图__________。
(2)写出基态时G元素原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为____________ 。
(3)第一电离能介于R、B之间的第二周期元素有_____________种。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)配合物甲的焰色反应呈紫色,其内界由中心离子J3+与配位体AB-构成,配位数为6,甲的水溶液可用于实验室J2+的定性检验,此方法检验J2+的离子方程式为_____________________。
(6)写出Q元素的简写电子排布式___________________________________。
-
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.

(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号)______;
元素j的最高价氧化物的化学式为______,元素i最高价氧化物的水化物的化学式为______.
(2)最外层上未成对电子数最多的元素是______(填元素符号).f单质及Fe单质的融合物两者所属晶体类型是______.
(3)写出m原子的外围电子排布式______.
-
下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。

(1)上述元素的单质中熔点最高的可能是________(填字母);dh4比gh4稳定,其原因是______。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_____________。
(3)f的氢化物属于___晶体,a与d形成的化合物da4的立体构型是___,它的晶体属于_____晶体。
(4) c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用○表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是________。

-
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。

(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
-
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2) i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物是溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
-
(8分)下表为元素周期表的一部分。表中所列的字母分别代表某一元素。

(1)元素F的名称是_____________;
(2)B、C、D、E四种元素的氢化物中最稳定的是____________(写化学式);
(3)写出B的最高价氧化物的电子式________;
(4)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为________。



 试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。





