-
某化学小组在实验室模拟用软锰矿(主要成分 ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
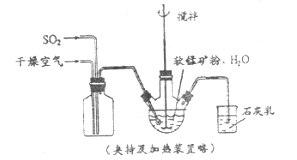
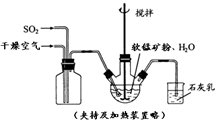
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: 
 (铁浸出后,过量的
(铁浸出后,过量的 会将
会将 还原为
还原为 )
)
②向“浸锰”结束后的烧瓶中加入一定量纯 粉末。
粉末。
③再用 溶液调节pH为3.5左右,过滤。
溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入 ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
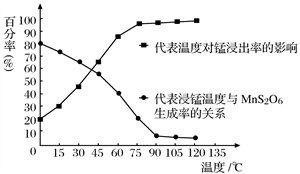
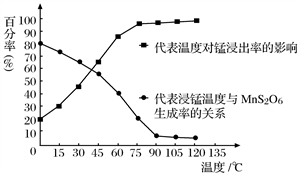
(1)“浸锰”反应中往往有副产物 的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,温度对“浸锰”反应的影响如下图,为减少 的生成,“浸锰”的适宜温度是___________。
的生成,“浸锰”的适宜温度是___________。
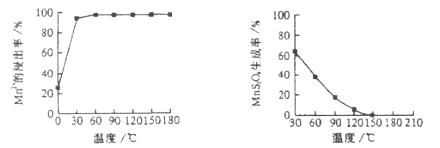
图1 温度对锰浸出率的影响 图2 浸锰温度与 生成率的关系
生成率的关系
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯 粉末的主要作用是_________,相应反应的离子方程式为_______。
粉末的主要作用是_________,相应反应的离子方程式为_______。
表1:生成相应氢氧化物的pH
| 物质 | 
| 
| 
| 
|
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有 ,可添加过量的难溶电解质MnS除去
,可添加过量的难溶电解质MnS除去 ,经过滤,得到纯净的
,经过滤,得到纯净的 。用平衡移动原理解释加入MnS的作用__________。
。用平衡移动原理解释加入MnS的作用__________。
(4)④中加入 后发生反应的离子方程式是__________。
后发生反应的离子方程式是__________。
-
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6 的生成,“浸锰”的适宜温度是________。
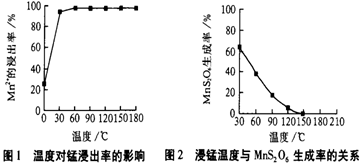
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯MnO2粉末的主要作用是________,相应反应的离子方程式为________。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是________。
-
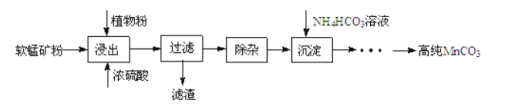
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为 ,含少量
,含少量 等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )已知室温下:
等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )已知室温下: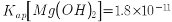 ,
,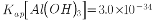 ,
,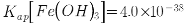 。)
。)
A.试剂X可以是 等物质
等物质
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去 等杂质
等杂质
C.浸出时加入植物粉的作用是作为还原剂
D.为提高沉淀 步骤的速率可以持续升高温度
步骤的速率可以持续升高温度
-
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
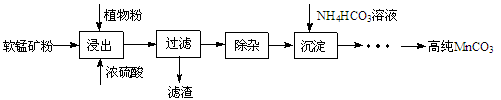
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
-
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
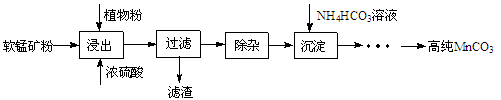
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)
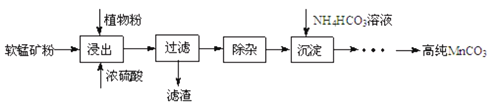
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.浸出时加入植物粉的作用是作为还原剂
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
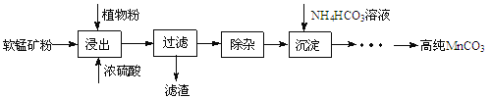
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
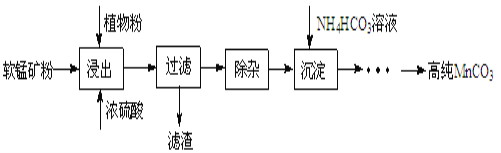
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
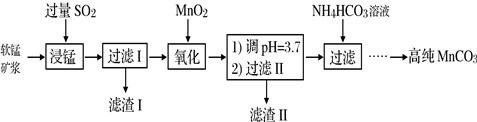
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
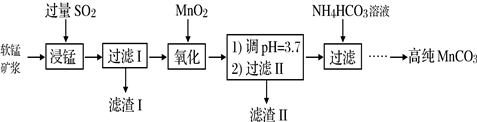
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):

(铁浸出后,过量的
会将
还原为
)
粉末。
溶液调节pH为3.5左右,过滤。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,“浸锰”的适宜温度是___________。

生成率的关系
粉末的主要作用是_________,相应反应的离子方程式为_______。
,可添加过量的难溶电解质MnS除去
,经过滤,得到纯净的
。用平衡移动原理解释加入MnS的作用__________。
后发生反应的离子方程式是__________。


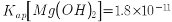 ,
,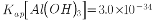 ,
,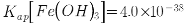 。)
。)








