-
(14分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2 (g) 2SO3(g),△H<0
2SO3(g),△H<0
(1)写出该反应的化学平衡常数表达式K= 。
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
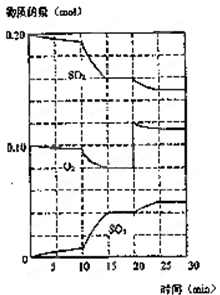
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
-
(12分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式:K=________。
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速率________(以上均填“增大”、“减小”或“不变”)。
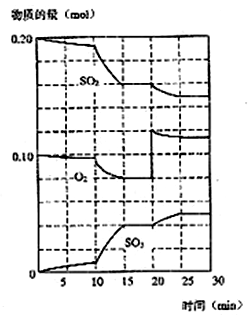
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如下图所示,反应处于平衡状态的时间段是________。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是________(用文字表达),10min~15min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.扩大容器体积 c.降低温度 d.增加SO3的物质的量
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
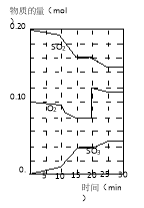
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因 (用文字表达)
(4)10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
-
在一定条件下,二氧化硫和氧气发生 如下反应:
2SO2(g)+ O2 (g)  2SO3(g) (△H< 0)
2SO3(g) (△H< 0)

(1)降低温度,二氧化硫转化率_________,化学反应速率_(以上均填增大、减小或不变)
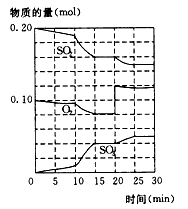
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间____________。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是_____________(用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) (△H< 0)
2SO3(g) (△H< 0)
(1)降低温度,二氧化硫转化率_________,化学反应速率_(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_______________ 。
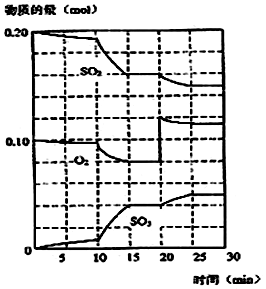
(3)据图判断,反应进行至20min时,曲线发生变化的原因 _____________ (用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。
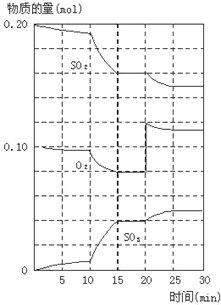
(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g) 2SO3(g) (△H<0)
2SO3(g) (△H<0)
(1)写出该反应的化学平衡常数表达式 K=__________。
(2)降低温度,该反应K值__________(填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有__________。
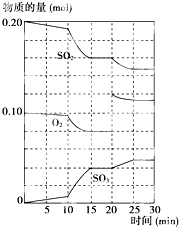
(4)据图判断,反应进行至20min时,曲线发生变化的原因是__________(用文字表达);
(5)10min到15min的曲线变化的原因可能是__________(填写编号)。
A.降低温度 B.增加SO3的物质的量
C.加了催化剂 D.缩小容器体积
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
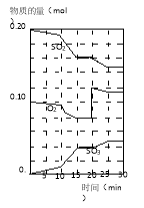
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
-
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0
(1)写出该反应的化学平衡常数表达式K=______
(2)降低温度,该反应K值______(填“增大、减小或不变”)
(3)在600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是______和25-30min.
(4)在第一次平衡状态时,SO2的转化率是______.
(5)在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L.通过计算,判断此混合体系中反应进行的方向.要求写出具体的计算过程.
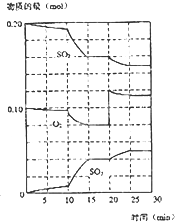
-
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=________.
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速率________(以上均填增大、减小或不变).
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________.
(4)据图判断,反应进行至20min时,曲线发生变化的原因是________(用文字表达)
(5)10min到15min的曲线变化的原因可能是________(填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.