-
五氧化二钒(V2O5,摩尔质量为182 g·mol-1)可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性,属于两性氧化物。某研究小组将从某粗钒(主要含有V2O5,还有少量Al2O3、Fe2O3)中提取V2O5。实验方案设计如下:
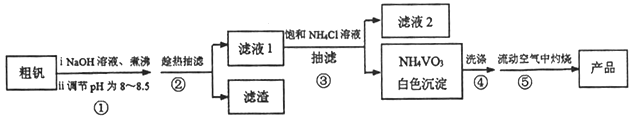
已知:NH4VO3是白色粉末,微溶于冷水,可溶于热水,不溶于乙醇、醚。
2NH4VO3 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)第①步操作的实验装置如右图所示,虚线框中最为合适的仪器是________。(填编号)





(2)调节pH为8~8.5的目的________。
(3)第④步洗涤操作时,可选用的洗涤剂_________。(填编号)
A.冷水 B.热水 C.乙醇 D.1% NH4Cl 溶液
(4)第⑤ 步操作时,需在流动空气中灼烧的可能原因________。
(5)硫酸工业中,SO2转化为SO3的催化剂就选用V2O5,催化过程经两步完成,将其补充完整:________( 用化学方程式表示),4VO2+O2=2V2O5。
(6)将0.253 g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中含有V3+,滴加指示剂,用0.250 mol·L-1Na2S2O3溶液滴定,达到终点消耗Na2S2O3标准溶液20.00 mL,则该产品的纯度为________。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
-
V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
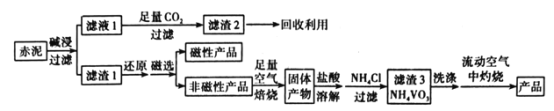
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol•L-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
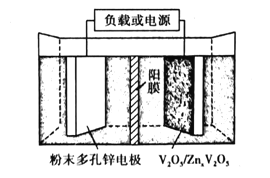
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。
-
五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
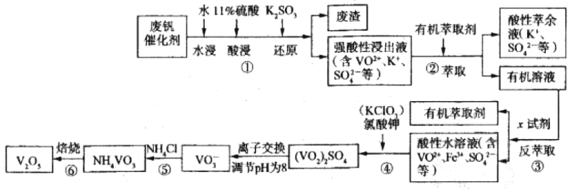
(1)①中废渣的主要成分是__________________________;
①中V2O5发生反应的离子方程式为________________________________________。
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4) (水层)+2nHA(有机层)  2RAn(有机层)+nH2SO4(水层)。
2RAn(有机层)+nH2SO4(水层)。
②中萃取时必须加入适量碱,其原因是________________________________________;
实验室进行萃取操作使用的玻璃仪器为________________________________________。
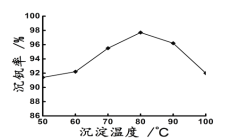
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验当加入100ml0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是________________[M(V2O5)=182g/mol]
(4)25℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:

试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为_________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤__________。已知:25℃时Ksp[Fe(OH)3]=2.6×10-39
-
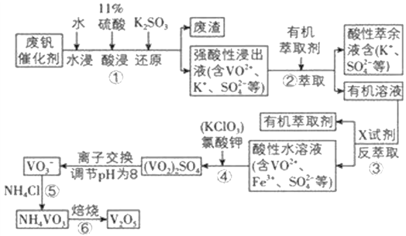
五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
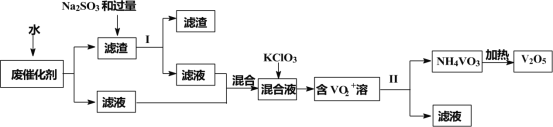
已知:①部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH- VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________。
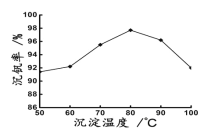
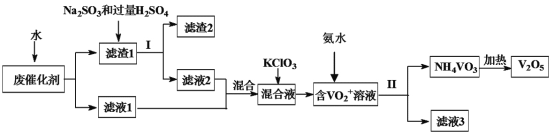
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________;____________(写两条)。
(7)该工艺流程中可以循环利用的物质为____________。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L−1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L−1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是____________。(列出计算式)
-
五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
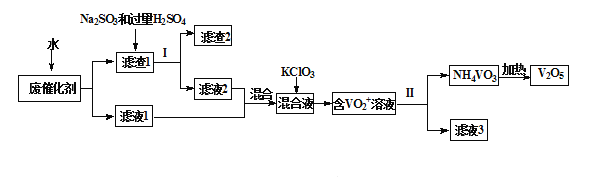
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b. +2OH-
+2OH-
 +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
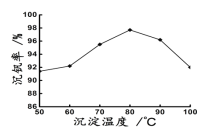
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol−1)的质量分数是______。(列出计算式)
-
五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如图:
已知:(1)部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)VO2++OH- VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,在不加试剂情况下,可以采取的措施为__(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为__(填离子符号)。
(3)每生成1mol(VO2)2SO4时转移电子的数目为___。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为___。
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__。
(6)新工艺流程的最后,钒以NH4VO3的形式沉淀出来;如图中横坐标表示反应II的温度,纵坐标表示沉钒率,沉钒率是指NH4VO3沉淀中V元素的质量和废催化剂中V元素的质量之比,也即是钒的回收率。请解释图中温度超过80℃以后,沉钒率下降的可能原因是___。
(7)该工艺流程中可以循环利用的物质为__。
(8)若实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100克该废钒催化剂按工业生产的步骤进行实验。当加入100mL0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设与KClO3反应后的操作步骤中钒没有损失,则该实验中钒的回收率是__(保留3位有效数字)。
-
五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣(主要含有V2O3,还有少量FeO、Al2O3、SiO2等)为原料生产V2O5的工艺流程如图:

已知:VO +H2O
+H2O VO
VO +2H+
+2H+
(1)“焙烧”时,V2O3转化为NaVO3的化学方程式是___。
(2)滤渣1为___(填化学式),“酸浸”后,调pH=7.6,除了得到沉淀Fe(OH)3、___,另一个目的是___。
(3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是___。图1是沉钒率随温度的变化曲线,温度高于80℃,沉钒率下降,其可能原因是___。

(4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量x100%)随温度变化的曲线如图2所示。NH4VO3分解过程中,先后失去的物质分别是___、___。(填化学式)
(5)金矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
-
五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5 的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一种生产工艺流程示意图:
部分含钒物质在水中的溶解性如表所示,回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)①中废渣的主要成分是 __________________________;①中V2O5 发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层)⇌ 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ______________________;实验室进行萃取操作使用的玻璃仪器为 ______________________。
(3)实验室用的原料中V2O5 占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 mol•L -1 的KClO3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是 __________________[M(V2O5)=182 g•mol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________;若钒沉淀率为 93.1%时不产生 Fe(OH)3 沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。
-
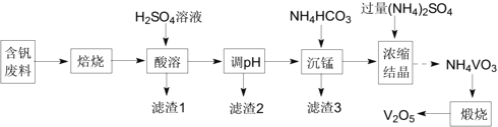
五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
| Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__ 写出2种即可
写出2种即可 ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__ 填“是”或“否”
填“是”或“否” ;
; 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率( ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。 填写分子式
填写分子式
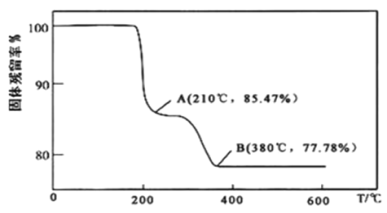
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色 被还原为VO2+蓝色
被还原为VO2+蓝色 ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。
-
氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
(1).工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl + Na2CO3 2CuCl ↓+ 3Na2SO4 + CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 g,需要水 g。
(2).实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl–)=0.032mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
(3).由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?

V2O5+2NH3↑+H2O



















 ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。