-
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
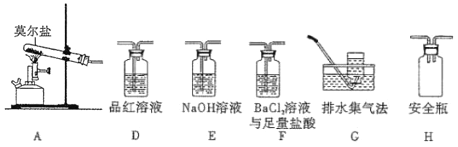
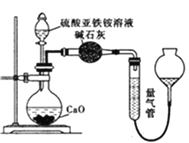
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。
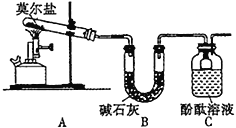
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:
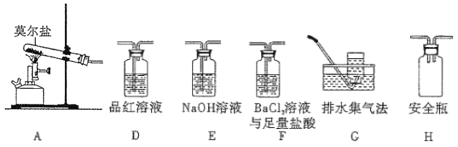
①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol•L-1的酸性K2Cr2O7溶液分三次进行滴定。
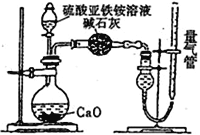
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
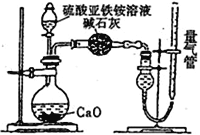
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
-
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。
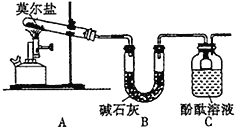
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:
①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol•L-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
-
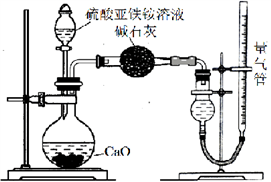
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] (俗称莫尔盐)可溶于水,在100℃~110℃时分解。为探究其化学性质,甲、乙两同学设计了如下实验。
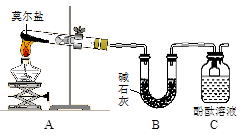
Ⅰ.探究莫尔盐晶体加热时的分解产物。
甲同学设计如右图所示的装置进行实验,装置C中可观察到的现象是____________________,由此可知分解产物中有_______________。
乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
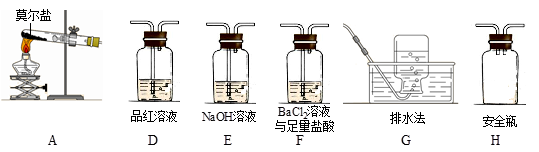
①乙同学的实验中,装置依次连接的合理顺序为:A→H→(____)→(____)→(____)→G。
②证明含有SO3的实验现象是______________;安全瓶H的作用是____。
Ⅱ.为测定硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取25.00 mL样品溶液用0.1000 mol·L-1的酸性K2Cr2O7 溶液分三次进行滴定。乙方案:(通过NH4+测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
请回答:
(1)甲方案中的离子方程式为:________________________。
(2)乙方案中量气管中最佳试剂是________
a.水 b.饱和NaHCO3溶液 c.CCl4
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是________________。
(4)若测得NH3为V L(已折算为标准状况下),则硫酸亚铁铵纯度为_____(列出计算式)。
-
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)可溶于水,在100℃-110℃时分解。为探究其化学性质,甲、乙量同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如右图所示的装置进行实验,装置C中可观察到的现象是_____,由此可知分解产物中有_______。
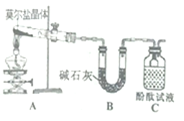
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
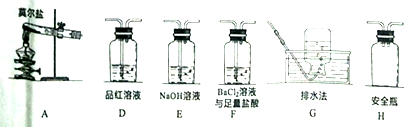
①乙同学的实验中,装置依次连接的合理顺序为: __________A→H→(_____)→(_____)→E→G。
②证明含有SO3的实验现象是__________;安全瓶H的作用是____________。
Ⅱ.为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。甲、乙两位同学设计了如下两个实验方案。(已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]的分子量为392)
甲方案:取25.00mL样品溶液用0.1000 mol/L的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+ 测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
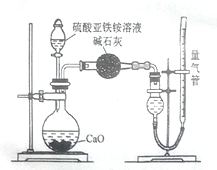
请回答:
(1)甲方案中的离子方程式为:_____________。
(2)乙方案中量气管中最佳试剂是_____________。
a.水 b.饱和NaHCO3溶液 c.CCl4
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________。
(4)若测得NH3(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为______。
-
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] (俗称莫尔盐)可溶于水,在100℃~110℃时分解。为探究其化学性质,甲、乙两同学设计了如下实验。
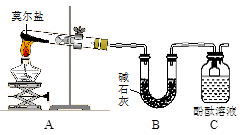
Ⅰ.探究莫尔盐晶体加热时的分解产物。
甲同学设计如右图所示的装置进行实验,装置C中可观察到的现象是____________________,由此可知分解产物中有_______________。
乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
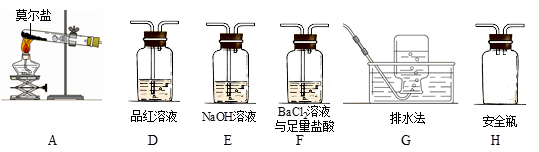
①乙同学的实验中,装置依次连接的合理顺序为:A→H→(____)→(____)→(____)→G。
②证明含有SO3的实验现象是______________;安全瓶H的作用是____。
Ⅱ.为测定硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取25.00 mL样品溶液用0.1000 mol·L-1的酸性K2Cr2O7 溶液分三次进行滴定。乙方案:(通过NH4+测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
请回答:
(1)甲方案中的离子方程式为:________________________。
(2)乙方案中量气管中最佳试剂是________
a.水 b.饱和NaHCO3溶液 c.CCl4
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是________________。
(4)若测得NH3为V L(已折算为标准状况下),则硫酸亚铁铵纯度为_____(列出计算式)。
-
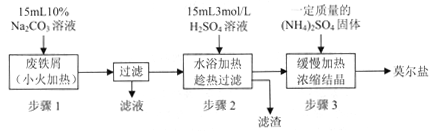
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
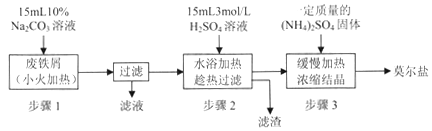
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
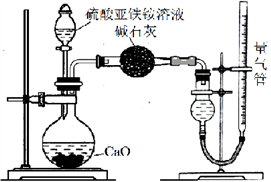
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
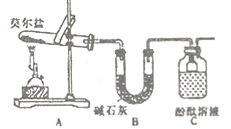
Ⅰ.化学课外活动小组研究莫尔盐晶体强热时的分解产物。
(1)甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是___________,由此可知分解产物中有_____________。
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
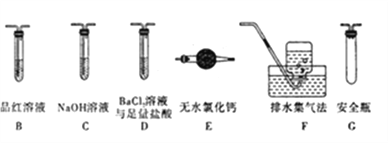
①乙组同学的实验中,装置依次连接的合理顺序为A、__________________。
②装置D中足量盐酸的作用是____________;含有SO3的实验现象是_______________。
Ⅱ.为测硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500mL溶液.甲、乙、丙三位同学设计了如下三个实验方案,请回答:
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol·L-1的酸性KMnO4溶液分三次进行滴定。
乙方案:取25.00mL硫酸亚铁铵溶液进行如下实验。
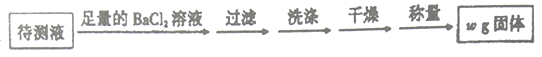
丙方案:(通过NH4+测定)实验设计图如下图所示,取25.00mL硫酸亚铁铵溶液进行该实验。
(3)甲方案中的离子方程式为______________________,若实验操作都正确,但其测定结果总是小于乙方案,可能原因为________________,验证推测的方法为___________________________________ 。
(4)乙方案中沉淀是否洗涤干净的检验方法是______________________________。
(5)丙方案中量气管中最佳试剂是__________________
a.水 b.饱和NaHCO3溶液 c.CCl4
(6)若测得NH3体积(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_________________。
-
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O,M=392g·mol-1],俗称莫尔盐,是一种蓝绿色的无机复盐,易溶于水,在100℃~110℃时分解。
回答下列问题:
Ⅰ.探究莫尔盐强热时的分解产物
某同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,该同学用下列装置进行实验。

(1)该同学的实验中,装置依次连接的合理顺序为A→H→___→G。
(2)证明分解产物中含有SO3的实验现象是__。
Ⅱ.探究莫尔盐的纯度
某学生取mg莫尔盐样品配制成500mL溶液,根据物质组成,分别设计了如下实验方案。
方案甲:取20.00mL所配溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
方案乙:取20.00mL所配溶液进行如下实验。

(3)方案甲中盛装标准溶液的仪器名称为__;涉及反应的离子方程式为__;达到滴定终点的现象是___。
(4)方案乙测得样品的纯度为__%(用含m、w的式子表示)。
(5)若实验操作都正确,但方案甲的测定结果总是小于方案乙,其可能原因为__。设计实验,验证你的假设__。
-
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],俗名莫尔盐,蓝绿色的固体,易溶于水,几乎不溶于乙醇,在 100℃~110℃时分解,对光敏感。在空气中逐渐风化及氧化。在空气中比硫酸亚铁稳定,有还原性。常用作重铬酸钾、高锰酸钾等溶液的互相标定的标准物质。一般用废铁屑经以下流程制取:

(1)检验莫尔盐固体中亚铁离子,可将样品溶于水后,滴加 K3[Fe(CN)6]溶液,反应的现象是________________。
(2)下列说法中正确的有____。
A.用 NaOH 溶液洗涤废铁屑的作用是去除废铁屑表面的油污和氧化铁杂质
B.蒸发应用小火小心加热,直到出现大量晶体停火利用余热蒸干溶剂
C.过滤后可用少量乙醇洗涤
D.检验莫尔盐固体样品中铵离子,可将样品溶于水后,再加足量 NaOH 稀溶液,将湿润的红色石蕊试纸置于试管口,若观察到试纸变蓝,表明固体中存在 NH4+,否则无 NH4+
E.检验莫尔盐固体是否氧化变质,可将样品溶于水后,滴加 KSCN 溶液,溶液变红,说明氧化变质
(3)用重铬酸钾溶液标定(滴定)莫尔盐溶液浓度,若需配制浓度为 0.01000mol•L-1 的 K2Cr2O7 标准溶液 250mL,应准确称取____________________g K2Cr2O7(保留 4 位有效数字,已知 M( K2Cr2O7)=294.0g•mol-1).配制该标准溶液时,下列仪器中不必要用到的有__________________ .
①电子天平 ②烧杯 ③温度计 ④玻璃棒 ⑤容量瓶⑥铁架台(带铁圈) ⑦胶头滴管
滴定操作中,如果滴定前装有 K2Cr2O7 标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____(填“偏大”、“偏小”或“不变”)。
(4)向(NH4)2Fe(SO4)2 溶液中滴加一定量的 NaOH 溶液时,发生的总反应的离子方程式一定错误的是____。(填字母)
A.Fe2++2OH-===Fe(OH)2↓
B.NH4++OH-===NH3·H2O
C.Fe2++3OH-+NH4+===Fe(OH)2↓+NH3·H2O
D.Fe2++5OH-+3NH4+===Fe(OH)2↓+3NH3·H2O























