-
(共14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2 molN2;的和0.6 molH2的,在一定条件下发生反应: ,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。
,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。
(2)平衡后,若要提高H2的转化率,可以采取的措施有______。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
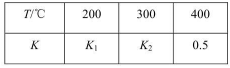
 ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较 、
、 的大小,
的大小, ____
____  (填“<”、“>”或“=”):
(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应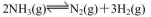 的化学平衡常数为____。当测得NH3、N2和H2 物质的量分别为3 mol、2 mol和1 mol时,则该反应的
的化学平衡常数为____。当测得NH3、N2和H2 物质的量分别为3 mol、2 mol和1 mol时,则该反应的 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是____。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
-
(16分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
(2)平衡后,若要提高H2的转化率,可以采取的措施有________。
A.加了催化剂 B.增大容器体积C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2 B.v(H2)正=3v(H2)逆
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________ v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________ v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
(2)平衡后,若要提高H2的转化率,可以采取的措施有________。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)  2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
-
(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
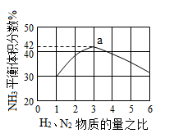
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小 B.正反应速率加快,逆反应速率减慢
C.NH3的物质的量增加 D.平衡常数K增大
E.平衡向正方向移动
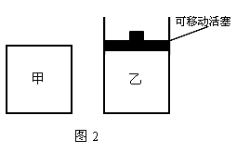
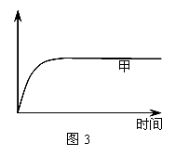
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。

(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.NH3的物质的量增加
D.平衡常数K增大
E.平衡向正方向移动
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
-
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用。
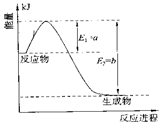
①右图是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
________________________________________________________。
(△H的数值用含字母a、b的代数式表示)
②在25°C时,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液显中性,则反应后的溶液中:c(NH4+)_______c(Cl-)(填“>”、“<”或“=”)
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C时,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1的硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是________________,产生该现象的原因是(用离子方程式表示)_______________________________________________________。
(3)下图为一电化学装置,电极分别为铁棒和碳棒。U形管中盛有电解质溶液。
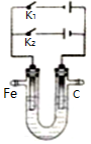
①若U形管中盛有饱和食盐水,打开K2,闭合K1, 铁棒为_______ 极, 碳棒上的电极反应式为_____________________________________________。
②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子。闭合K2,打开K1,阳极区所发生的反应有:Fe-2e- =Fe2+和 _________________________________________ (写离子反应方程式)
-
(14分)氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K= ________
②试判断K1 ________K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 ________(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
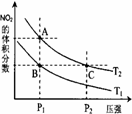
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=________, 以NH3表示该过程的反应速率v(NH3)= ________。
 ,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。
,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。 ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
、
的大小,
____
(填“<”、“>”或“=”):
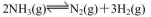 的化学平衡常数为____。当测得NH3、N2和H2 物质的量分别为3 mol、2 mol和1 mol时,则该反应的
的化学平衡常数为____。当测得NH3、N2和H2 物质的量分别为3 mol、2 mol和1 mol时,则该反应的 (填“<”、“>”或“=”)。







