-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
高三化学实验题中等难度题查看答案及解析
-
(16分)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、__▲_____、转移、洗涤并转移、____▲____摇匀。
② 加入锌粉的目的是___▲_____。
③ 写出步骤三中发生反应的离子方程式___▲_____。
④ 实验测得该晶体中铁的质量分数为_____▲____。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量___▲____。(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
高三化学填空题中等难度题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______摇匀.
②加入锌粉的目的是______.
③写出步骤三中发生反应的离子方程式______.
④实验测得该晶体中铁的质量分数为______.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量______.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
加热晶体,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;______;______.高三化学解答题中等难度题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______摇匀.
②加入锌粉的目的是______.
③写出步骤三中发生反应的离子方程式______.
④实验测得该晶体中铁的质量分数为______.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量______.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
加热晶体,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;______;______.高三化学解答题中等难度题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、________、摇匀。
②“步骤一”所得溶液的颜色为________。
③写出“步骤二”中加锌粉产生气泡的离子方程式________;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式________。
④“步骤三”KMnO4溶液应装在________式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是________ ________ ________;
判断滴定至终点依据的现象是________ ________。
⑤实验测得该晶体中铁的质量分数为________。
高三化学实验题中等难度题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:______,______.
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是______.
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式______.
(4)上述实验滴定时,指示剂应该______(填“加”或“不加”),如何判断滴定终点:______.
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量______.(选填“偏低”“偏高”“不变”)
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为______.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是______
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.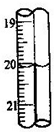
高三化学解答题中等难度题查看答案及解析
-
(本题共12分)
三草酸合铁酸钾(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,110℃时失去全部结晶水。
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+。向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+ 。
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL。
37.配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_____、冷却、转移、洗涤并转移、_____、摇匀。
38.加入锌粉的目的是__________________。
39.写出步骤三中发生反应的离子方程式_______________________。
40.实验测得该晶体中铁的质量分数为______________。在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量_________。(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。
41.请纠正上述实验过程中的两处错误:___________________________________________
高三化学实验题困难题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量,某实验小组做了如下实验:
(1)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250moL溶液,取所配溶液25.00moL与锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至溶液完全由黄色变为浅绿色时,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍成酸性.加入锌粉的目的是______.
(2)向(1)锥形瓶中先加入足量稀硫酸,后用0.01mol/LKnMO4溶液滴定上一步骤所得的溶液至终点,消耗KMnO4溶液20.02moL,滴定中被还原成Mn2+.写出发生反应的离子方程式:______
(3)上述实验滴定时,指示剂应该______(填“加”或“不加”),判断滴定终点的现象是:______
(4)再重复(1)、(2)步骤两次,滴定消耗0.01moL/KMnO4溶液平均体积为19.98moL.计算确定该晶体中铁的质量分数(写出计算过程,结果保留两位小数)高三化学解答题中等难度题查看答案及解析
-
三草酸合铁(III)酸钾K3[Fe
(C
2O4)3]•3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:Ⅰ.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O4•2H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O4•2H2O晶体的化学方程式___。检验FeC2O4•2H2O晶体是否洗涤干净的方法是___。
(2)步骤②中检验Fe2+是否完全转化的操作为___。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是___。
Ⅱ.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,MnO4-被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯____,___,___。
(5)写出步骤三中发生反应的离子方程式____。
(6)实验测得该晶体中铁的质量分数为____(结果保留3位有效数字)。
高三化学实验题困难题查看答案及解析
-
三草酸合铁酸钾是一种重要的光敏材料和有机反应的催化剂,化学式为K3[Fe(C2O4)3]·3H2O,为翠绿色晶体,溶于水,难溶于乙醇。110℃下失去三分子结晶水,230℃时分解。该配合物对光敏感,光照下即发生分解。
Ⅰ、三草酸合铁酸钾的制备
①溶【解析】
在托盘天平上称取4.0gFeSO4·7H2O晶体,放入250mL烧杯中,加入1 mol·L-1 H2SO4 1mL,再加入H2O 15mL,加热使其溶解。②沉淀:在上述溶液中加入1 mol·L-1 H2C2O4 20mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾斜法倒出清液,洗涤该沉淀3次以除去可溶性杂质。
③氧化:在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20mL,不断搅拌溶液并维持温度在40℃左右,使Fe2+充分氧化为Fe3+。滴加完后,加热溶液至沸腾以除去过量的H2O2。
④生成配合物:保持上述沉淀近沸状态,趁热滴加1 mol·L-11H2C2O4使沉淀溶解至呈现翠绿色为止。冷却后,加入15mL 95%的乙醇水溶液,在暗处放置,结晶。减压过滤,抽干后用少量乙醇洗涤产品,继续抽干,称量,计算产率,并将晶体放在干燥器内避光保存。
Ⅱ、产物中C2O42-的质量分数的测定
称取0.20g产品于锥形瓶中微热溶解并加入2 mL稀硫酸,趁热用0.0200 mol·L-1 KMnO4标准溶液滴定至终点,重复操作2-3次,平均消耗KMnO4溶液的体积为25.00mL。计算产物中C2O42-的质量分数。 请回答下列问题:
(1)步骤①溶解时应加入少量的稀硫酸,目的是__________________________;
(2)步骤③用过氧化氢作氧化剂而不选择KMnO4的理由是_______________________;
(3)生成的FeC2O4·2H2O晶体上易沾附硫酸盐,如何证明晶体已洗涤干净______________;
(4)步骤③需保持恒温40℃,原因是__________________________;
(5)用乙醇洗涤的作用是______________________________________________________;
(6)滴定终点的现象是_____________________________________,通过计算,产物中C2O42-的质量分数为____________________。
高三化学简答题困难题查看答案及解析