-
高铁酸钾是一种高效多功能水处理剂.工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4;3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
(1)写出反应①的离子方程式______
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)______Ksp(Na2FeO4)(填“>”或“<”或“=”).
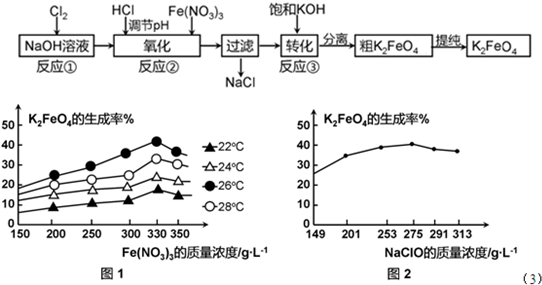
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为______.
②若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______
(4)K2FeO4 在水溶液中易水【解析】
4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______ 溶液(填序号).
4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______ 溶液(填序号).
A.H2O B.CH3COONa、异丙醇C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇.
-
(12分)高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下:

(1)写出反应①的离子方程式。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”或“<”或“=”)。

(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
上左图为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
右图为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
①工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为________。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
________。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:________。
(4)K2FeO4 在水溶液中易水【解析】
4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________________溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________________溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
-
(12分)高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
(1)写出反应①的离子方程式_____________________________。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) _________ Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。

①工业生产中最佳温度为_______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为_______。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
____________________________________________________。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____________________________________。
(4)K2FeO4 在水溶液中易水【解析】
4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
-
高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,Na2FeO4+2KOH=K2FeO4+2NaOH,主要的生产流程如下:
(1)写出反应①的离子方程式________.
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)________Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.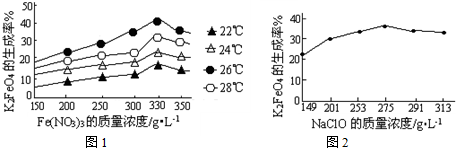
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为________℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为________.
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:________.
③若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:________.
(4)K2FeO4 在水溶液中易水【解析】
4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________溶液(填序号).
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇.
-
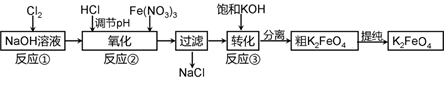
高铁酸钾是一种新型高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量。实验室用pH试纸测定溶液pH的操作是。
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。

工业生产中最佳温度为________℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为________。
(4)K2FeO4 在水溶液中易“水解”:4FeO42- + 10H2O  4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________ 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________ 溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。根据污染物的实际情况向水中加入适量的K2FeO4将污染物转化为无污染的物质,试写出K2FeO4处理含有NH3污水时与NH3反应的离子方程式________。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其生产工艺如下:

主要反应为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)写出反应①的离子方程式:______.
(2)从“混合物II”中分离出K2FeO4后,会有副产品______(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途______.
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
根据图分析:工业生产中最佳温度为______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为______.
(4)K2FeO4 在水溶液中易水【解析】
4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol•L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅲ.该实验的目的是______.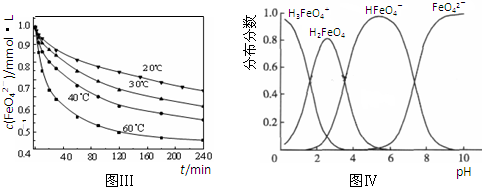
(6)FeO42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是______(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O.
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
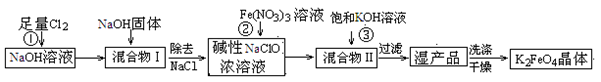
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式:。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是________。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
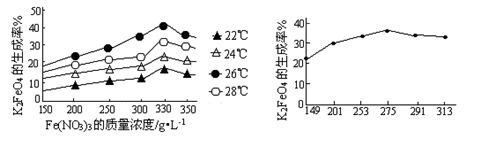
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为________℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为________。
-
(9分)高铁酸钠是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品。反应方程式为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
(1)上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是 。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应方程式 。
(3)生产高铁酸钠的原料之一Fe(NO3)3用黑色粉末Fe(含有Fe3O4)与稀硝酸反应制备。准确称取该黑色粉末13.12g,加入200mL 4 mol·L-1 HNO3搅拌,固体完全溶解,共收集到标准状况下2688mL的气体,经分析其中只含有NO,并测得此时溶液中c(H+)=0.4mol·L-1(设反应前后溶液体积不变)。通过以上数据,计算该黑色粉末中Fe的质量分数。(写出计算过程,结果保留两位小数)
-
高铁酸钾(K2FeO4)是一种新型、高效的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeC13+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾。下列说法不正确的是
A. NaC1O在反应中作氧化剂
B. 制取高铁酸钠时,每生成1mol Na2FeO4,反应中共有6mol电子转移
C. 高铁酸钾在低温下的溶解度比高铁酸钠的溶解度小
D. K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
-
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:湿法制备的主要离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,干法制备的主要反应方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。则下列有关说法不正确的是( )
A.高铁酸钠中铁显+6价
B.湿法中FeO42-是氧化产物
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质


4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________________溶液(填序号)。











