-
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),酸性K2Cr2O7溶液可将这种碳纳米颗粒氧化为无毒气体而除去,该反应的还原产物为Cr3+,请写出相应的离子方程式:___________________________。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)  CH3OH (g) ΔH1=-116 kJ·mol-1
CH3OH (g) ΔH1=-116 kJ·mol-1
①下列措施中可增大H2的平衡转化率的是_________;
A.升高反应温度 B.增大体系压强
C.使用高效催化剂 D.及时将CH3OH与反应混合物分离
②向2L的恒容密闭容器中充入1mol CO和2mol H2,进行上述反应,5min后达到平衡状态,此时体系的压强变为原来的 。则此段时间v(H2)=__________mol·L-1·min-1 。
。则此段时间v(H2)=__________mol·L-1·min-1 。
③已知:
2CO (g) + O2 (g)  2CO2 (g) ΔH2=-566 kJ·mol-1
2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2 (g)  2H2O (g) ΔH3=-484 kJ·mol-1
2H2O (g) ΔH3=-484 kJ·mol-1
则气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为 _______________________;
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

请回答:
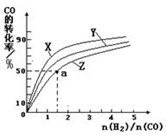
ⅰ.在上述三种温度中,曲线Z对应的温度是_______。
ⅱ.利用图中a点对应的数据,计算出曲线Z在对应温度下
CO (g) + 2H2 (g) CH3OH (g)的平衡常数K的值为 =_____。
CH3OH (g)的平衡常数K的值为 =_____。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为______。
-
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:

A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
| 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
-
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)生成0.5mol还原产物时,转移的电子的物质的量为 mol。
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式
____C+ ____KMnO4+ ____H2SO4→ ____CO2↑+ ____MnSO4+ ____K2SO4+____H2O
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为_____________________;
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=akJ/mol
CH3OH(g)△H=akJ/mol
如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①判断反应达到平衡状态的依据是_______
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2mol CO和一定量的H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则以H2表示的反应速率v(H2)=_______;
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下工作的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式_______;
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)═BaCO3(s)+SO42-(aq).已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则BaCO3的溶度积Ksp=_______。
-
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2molH2的同时消耗1mol CH3OH
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。
(2)已知: CO(g)+  O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+  O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
-
储氢纳米碳管研究成功体现了科技的进步.但用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应式为:

①配平上述反应,此反应的氧化剂是______,氧化产物是______;当有1mol C完全反应时转移______mol电子.
②H2SO4在上述反应中表现出来的性质是______(填选项序号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
由此可知上述反应所用硫酸应为______(填“浓”或“稀”)硫酸.请写
出碳单质与硫酸反应时的化学方程式:______ CO2↑+2SO2↑+2H2O
-
储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
| C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
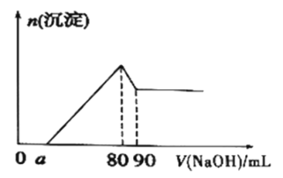
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
-
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
C + K2Cr2O7 + H2SO4→ CO2 + Cr2(SO4)3+ K2SO4 + H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目;________
(2)此反应的氧化剂是________,氧化产物是;
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.1mol CO2气体,则转移电子的物质的量是________mol。
-
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2 2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
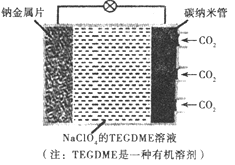
A. 充电时,Na+从阳极向阴极移动
B. 可以用乙醇代替TEGDME做有机溶剂
C. 放电时,当转移1mol电子负极质量减轻23g
D. 放电时,正极反应为3CO2 + 4Na++4e- = 2Na2CO3 + C
-
我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为4Na+3CO2 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
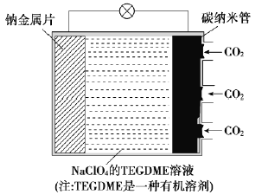
(1)钠金属片作为该电池的___极(填“正”或“负”,下同);放电时,电解质溶液中Na+从___极区向___极区移动。
(2)充电时,碳纳米管连接直流电源的___极,电极反应式为___。
CH3OH(g) △H1=-116 kJ·mol-1

O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=H2O(g) △H3=-242 kJ·mol-1





