-
已知: 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3) 的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。
回答下列问题:
(1)写出水溶液中草酸的第一步电离方程式________________________。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH_____(填“大”、“小”或“相等”)。
(3)常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为___________________________。
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为_______________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为____________。
高二化学综合题困难题查看答案及解析
-
已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH___(填“大”“小”或“相等”)。
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为____________________。
(3)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为______。
(4)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因:______。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______。
高二化学简答题困难题查看答案及解析
-
已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________(填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
高二化学填空题困难题查看答案及解析
-
已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH___(填“大”“小”或“相等”)。
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为____________________。
(3)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为______。
(4)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因:______。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______。
高二化学简答题困难题查看答案及解析
-
已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________(填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
高二化学填空题困难题查看答案及解析
-
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式:________________________________。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
高二化学填空题中等难度题查看答案及解析
-
(10分)乙二酸( HOOC—COOH)俗称草酸,易溶于水,,电离常数K1=5.4×10-2,K2=5.4×10-5,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸浓溶液,观察到有大量气泡产生,写出该反应的离子方程式: 。(碳酸:K1=4.4×10-7)
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ组装好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是 。写出乙二酸与少量乙醇反应的化学反应方程式 。

(3)已知草酸分解的化学方程式为:H2C2O4
H2O+CO2↑+CO↑
利用图Ⅱ①和图Ⅱ②加热草酸晶体(夹持仪器忽略),以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊。
能验证草酸受热分解的装置是 (填图Ⅱ中的编号“①”或“②”)。
(4)图Ⅱ①中冷凝管的作用是: 。
高二化学实验题困难题查看答案及解析
-
H2C2O4(乙二酸),俗名草酸,存在于自然界的植物中。已知常温下草酸电离平衡常数K1=5.0×10-2,K2=5.4×10-5,碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。Ksp (CaC2O4)=2.3×10-9,Ksp(CaCO3)=2.5×10-9。回答下列问题:
(1)写出草酸溶液中存在的主要电离反应方程式_____________________________________。
(2)长期将豆腐与菠菜混合食用,容易损失钙素且患胆结石疾病。理由是______________________。
(3)25℃,物质的量浓度均为0.1mol/L 的Na2C2O4溶液的pH比Na2CO3溶液pH_________(填“大”“ 小”或“相等”)。将上述两种溶液等体积混合后,滴加CaCl2溶液,当C2O42- 沉淀完全时,CO32-是否沉淀完全_______________(填“是”或“否”)
(4)写出NaHC2O4溶液中水解反应的离子方程式________________________________,计算常温下该反应的水解平衡常数为_____________________,NaHC2O4溶液的pH____7 (填“>”、“<”或“=”)
(5)向盛有饱和草酸溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的紫红色褪去,写出该反应的离子方程式________________________________________。
(6)设计实验证明草酸的酸性比碳酸强________________________________________。
高二化学综合题困难题查看答案及解析
-
Ⅰ.查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
(1)已知高锰酸钾能氧化草酸.反应如下(部分产物和生成物未写):MnO
+H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,则正极的电极反应式为___。
(2)某同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL0.2mol•L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,则其中含碳元素的粒子中物质的量浓度最小的微粒化学式为___。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。
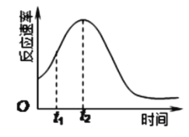
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:___。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
试管A
试管B
加入试剂
2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4
2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4,少量___固体(填物质名称)
实验现象
(褪色时间)
褪色时间10min
褪色时间___10min
(选填“<”“>”或“=”)
结论
猜想Ⅱ正确
Ⅲ.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液。
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/LNaOH溶液滴定,消耗NaOH溶液20.00mL。
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL。
回答下列问题:
(5)步骤③中判断滴定终点的方法是___。
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得H2C2O4·2H2O的质量分数___。(填“偏大”、“偏小”或“无影响”)
高二化学实验题中等难度题查看答案及解析
-
已知25℃时草酸(H2C2O4)的电离常数为K1=5.0×10-2,K2=5.4×10-5,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。不同温度下水的离子积常数见下表:
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.134
0.292
0.681
1.00
2.92
5.57
38.0
55.0
(1)25℃,将20 mL 0.2 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合后溶液显___________(选填“酸”、“碱”、“中”)性,混合后溶液中各离子浓度的由小到大的顺序为____________________;
(2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,试写出反应的离子方程式:________________________________。若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,溶液颜色的变化是____________________;若进行滴定实验时,锥形瓶中有少量蒸馏水,会使计算的结果_________(选填“偏高”、“偏低”、“无影响”)
(3)90℃时,将0.005 mol/L的氢氧化钙溶液20 mL与0.0012 mol/L的草酸溶液20 mL混合,混合后溶液的pH=___________;
(4)25℃时若向20 mL草酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的碳酸钾溶液10 mL,能否产生沉淀,___________(填“能”或“否”)。
高二化学填空题困难题查看答案及解析