-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH (g)+1/2O
(g)+1/2O (g)══CO(g)+2H
(g)══CO(g)+2H (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol ;
;
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
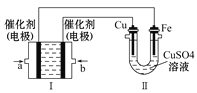
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。
-
(15分)甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气________L(标准状况下)。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为2L 2mol/LKOH溶液),通过装置Ⅱ制备稀H2SO4。若持续通入甲烷,在标准状况下,消耗甲烷的体积V L。
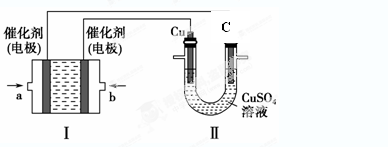
①0<V≤44.8时,装置Ⅰ的总反应方程式为: 。
②44.8<V≤89.6时,装置Ⅰ中负极电极反应为: 。
③装置Ⅱ中C棒上的电极反应式为: 。
④ 若装置Ⅰ中消耗的甲烷在标况下的体积为22.4L,则装置Ⅱ中理论上生成的H2SO4的物质的量为 mol。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
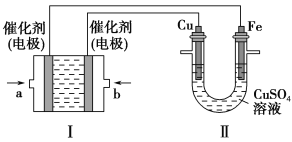
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉 冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=260kJ•mol﹣1
2CO(g)+2H2(g) △H=260kJ•mol﹣1
已知:2CO(g)+O2(g) 2CO2(g) △H=﹣566kJ•mol﹣1
2CO2(g) △H=﹣566kJ•mol﹣1
则CH4与O2反应生成CO和H2的热化学方程式为 。
(2)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处电极上发生的电极反应式: ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度 (填写“变大”、“变小”或“不变”),装置Ⅱ中Cu电极上发生的电极反应式: 。
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。

答
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为:_______________________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
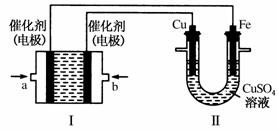
①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是 ;
②电镀结束后,装置Ⅰ中溶液的pH ;(填写“变大”“变小”或“不变”)
装置Ⅱ中Cu2+的物质的量浓度 ;(填写“变大”“变小”或“不变”)
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有 (忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极上分别通甲烷和氧气。其电极反应式分别为:负极_______________,正极______________。电池在放电过程中溶液的PH将___________(填“降低”、“升高”或“不变”)。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1
写出CH4(g)与H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为________________。
-
二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
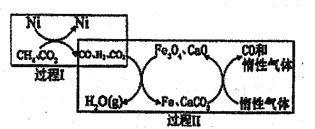
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
(g)+1/2O
(g)══CO(g)+2H
(g) ΔH1=-35.6kJ·mol
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
(g)+2O
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
;
(g)+CO
(g)=2CO(g)+2H
(g) ΔH3=+247.3kJ·mol
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。

的物质的量浓度___________________。







