-
(15分)已知几种离子的还原能力强弱顺序为I—>Fe2+>Br—,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)。
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是 ,剩余Fe2+的物质的量为 。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为 ,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为 。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是 。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式 ,上述所有反应共消耗Cl2 mol。
高二化学填空题极难题查看答案及解析
-
已知微粒还原性强弱顺序:I->Fe2+>Br-。向含有FeI2和FeBr2的溶液中通入一定量氯气后,经测所得溶液中有Fe2+、Cl-存在,则一定还存在的离子有( )
A.I- B.Br- C.Fe3+ D.Fe3+、I-
高二化学单选题中等难度题查看答案及解析
-
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br-
B. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3
D. 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-、Al(OH)3
高二化学选择题困难题查看答案及解析
-
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。已知:2Fe2++Br2===2Fe3++2Br- 2Fe3++2I-===2Fe2++I2 ,则下列有关说法中,不正确的是
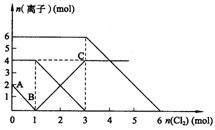
A.还原性:
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2==2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
高二化学选择题中等难度题查看答案及解析
-
已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如图所示,下列说法正确的是( )
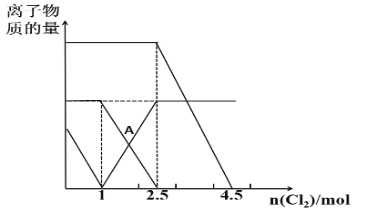
A.三种离子的还原性强弱关系是:Br->Fe2+>I-
B.A点表示Fe2+正好反应了一半
C.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3
D.当通入2.5molCl2时,溶液中已发生的离子反应可表示为:6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
高二化学多选题困难题查看答案及解析
-
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br﹣、2Fe3++2I﹣═2Fe2++I2,则下列有关说法中不正确的是( )
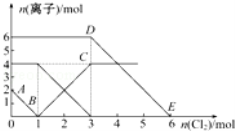
A.还原性:I﹣>Fe2+>Br﹣
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n(Br﹣)=6 mol
高二化学选择题困难题查看答案及解析
-
已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
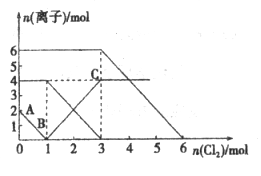
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
高二化学单选题困难题查看答案及解析
-
已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
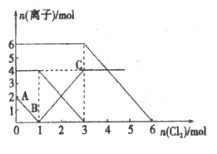
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为3mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入3mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
高二化学单选题困难题查看答案及解析
-
下列化学反应先后顺序判断正确的是( )
A.在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I—、Br—、Fe2+
B.在含有等物质的量的NaOH、Ca(OH)2 、NaAlO2 的溶液中通入CO2气体:NaOH、Ca(OH)2 、NaAlO2
C.在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、A13+、Al(OH)3
D.在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
高二化学选择题困难题查看答案及解析
-
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
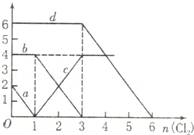
A.d曲线代表溶液中Br﹣变化情况
B.原溶液中FeI2的物质的量为2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
高二化学选择题中等难度题查看答案及解析